Sistema inmunitario

El sistema inmunológico es un conjunto de mecanismos que protegen un organismo de infecciones por medio de la identificación y eliminación de agentes patógenos. Debido a que los patógenos abarcan desde virus hasta parásitos intestinales, esta tarea es extremadamente compleja, en tanto que las amenazas deben ser detectadas con absoluta especificidad entre las células normales y los tejidos finos del organismo. A ello hay que sumar la capacidad evolutiva de los patógenos que les permite crear formas de evitar la detección por el sistema inmunológico e infectar al organismo huésped.
Para protegerse, los organismos vivos han desarrollado varios mecanismos para reconocer y neutralizar patógenos. Incluso organismos unicelulares simples —como las bacterias— poseen un sistema de enzimas que las protegen contra infecciones virales. Otros mecanismos inmunológicos básicos evolucionaron en antiguas células eucariotas y se encuentran hoy en sus descendientes modernos: plantas, peces, reptiles e insectos. Estos mecanismos incluyen péptidos antimicrobianos llamados defensinas, receptores de reconocimiento de patrón y el sistema del complemento. Sin embargo, los mecanismos más sofisticados se desarrollaron más recientemente en forma conjunta con la evolución de los vertebrados[1]. El sistema inmunológico de los vertebrados —como el de los seres humanos— consiste de varios tipos de proteínas, células, órganos y tejidos, que interactúan en una red elaborada y dinámica. Esta respuesta inmune más compleja que se manifiesta en el sistema inmunológico de los vertebrados, incluye la capacidad de adaptarse para así reconocer patógenos particulares en forma mas eficiente. El proceso de adaptación crea memorias inmunológicas y permite brindar una protección más efectiva durante futuros encuentros con estos patógenos. Este proceso de inmunidad adquirida es la base de la vacunación.
Los desórdenes en el sistema inmunológico pueden causar enfermedades. Las enfermedades relacionadas con la inmonudeficiencia ocurren cuando el sistema inmunológico está menos activo de lo normal, resultando en infecciones que pueden poner en peligro la vida. La inmunodeficiencia puede ser el resultado de una enfermedad genética, como una inmunodeficiencia severa combinada, o ser producida por fármacos o una infección, como el síndrome de inmunodeficiencia adquirida (sida), causado por el virus de inmunodeficiencia humana (VIH). En contraposición, las enfermedades autoinmunes son producidas por un sistema inmunológico hiperactivo que ataca tejidos normales como si fueran organismos extraños. Las enfermedades autoinmunes incluyen artritis reumatoide, diabetes mellitus tipo 1 y Lupus eritematoso. Debido al rol crítico que desempeña el sistema inmunológico en la salud humana, el mismo es centro de intensos estudios científicos.
Defensa inmune mediante múltiples barreras
El sistema inmunológico protege al organismo de infecciones mediante una estrategia de capas o barreras de defensa sucesivas, cada una más específica que la anterior.
El primer nivel lo forman las barreras físicas que previenen que los patógenos como las bacterias y los virus entren en el cuerpo. Si un patógeno traspasa estas primera barreras, el sistema inmunológico innato provee una respuesta inmediata, pero no específica. Los sistemas inmunológicos innatos se encuentran en todas las plantas y animales[2]. Sin embargo, si los patógenos evaden la respuesta innata, los vertebrados poseen una tercera capa de protección, que es el sistema inmunológico adaptativo. Aquí el sistema inmunológico adapta su respuesta durante la infección para mejorar el reconocimiento del patógeno.
La información sobre esta respuesta mejorada se conserva aún después de que el patógeno es eliminado, bajo la forma de memoria inmunológica, y permite que el sistema inmune adaptativo monte ataques más rápidos y más fuertes si en el futuro el sistema inmune detecta este tipo de patógeno[3].
| Sistema inmune innato | Sistema inmune adaptativo |
|---|---|
| La respuesta no es específica | Respuesta específica en patógenos y antígenos |
| La exposición conduce a la respuesta máxima inmediata | Tiempo de demora entre la exposición y la respuesta máxima |
| Células medias y componentes humorales | Células medias y componentes humorales |
| Sin memoria inmunológica | La exposición conduce a la memoria inmunológica |
| Presente en casi todas las formas de vida | Presente solo en vertebrados |
Tanto la inmunidad innata como la adaptativa dependen de la habilidad del sistema inmunológico para distinguir entre las moléculas propias y las que no lo son. En inmunología, las moléculas propias son aquellos componentes de un organismo que el sistema inmunológico distingue de las substancias extrañas. [4]. Al contrario, las moléculas que no son parte del organismo, son aquellas que son reconocidas como moléculas extrañas. Un tipo de moléculas extrañas llamadas antígenos (que significa "anti" cuerpo "gen" eradores), son substancias que se enlazan a receptores inmunes específicos, los cuales participan en el proceso de defensa ante ellos[5].
Barreras superficiales
Existe un gran número de tipos de barreras que protegen de infecciones, incluyendo barreras mecánicas, químicas y biológicas. La cutícula cerosa de una hoja, el exoesqueleto de un insecto, la cáscara de un huevo, y la piel son ejemplos de barreras mecánicas que forman la primera línea de defensa contra infecciones[5]. Sin embargo, como los organismos no están sellados, otros sistemas actúan para proteger las aberturas del cuerpo como los pulmones y el tracto genitourinario. En los pulmones, la tos y los estornudos expulsan por medios mecánicos a los elementos patógenos y otros organismos del tracto respiratorio.
El agua de las lágrimas y la orina, cumple también una acción de limpieza al producir el arrastre por medios mecánicos de elementos patógenos, mientras que las mucosas secretadas por los sistemas respiratorio y el tracto gastrointestinal sirven para atrapar microorganismos[6].
Las barreras químicas también protegen contra infecciones. La piel y el tracto respiratorio secretan péptidos antimicrobiales tales como las defensinas-β[7]. Enzimas tales como las lisosomas y la fosfolipasa A en la saliva, las lágrimas y la leche materna también son agentes antibacteriales[8][9]. Las secreciones de la vagina sirven como barreras químicas en la menarquia, cuando se vuelven ligeramente ácidas, mientras que el semen contiene defensinas y zinc para matar patógenos[10][11]. En el estómago, el ácido gástrico y las peptidasas funcionan como poderosas defensas químicas frente a patógenos ingeridos.
Dentro de los tractos genitourinarios y gastrointestinales, la flora comensal sirve como barrera biológica porque compite con las bacterias patógenas por alimento y espacio, y en algunos casos modificando las condiciones del medio, como el pH o el contenido de hierro disponible[12]. Esto reduce la probabilidad de que la poblacion de patógenos alcance el número suficiente de individuos como para causar enfermedades. Sin embargo, dado que la mayoría de los antibióticos no discriminan entre bacterias patógenas y la flora normal, los antibióticos orales pueden a veces producir un crecimiento excesivo de hongos (los hongos no son afectados por los antibióticos), como la infección de la levadura vaginal[13]. La reintroducción de flora probiótica, como el lactobacillus, encontrado en el yogurt, ayuda a restaurar un equilibrio saludable de las poblaciones microbiales en casos de infecciones intestinales.[14]
Inmunidad innata
Los microorganismos que han logrado penetrar en un organismo encontrarán las células y mecanismos del sistema inmune innato. Las defensas del sistema inmune innato no son específicas, lo cual significa que estos sistemas reconocen y responden a los patógenos en una forma genérica[5]. Este sistema no confiere inmunidad durante mucho tiempo contra el patógeno. El sistema inmune innato es el sistema dominante de protección en la gran mayoría de los organismos[2].
Barreras humorales y químicas
Inflamación
La inflamación es una de las primeras respuestas del sistema inmune a una infección[15]. Los síntomas de la inflamación son el enrojecimiento y la hinchazón, que son causadas por el incremento del flujo de sangre en un tejido. La inflamación es producida por eicosanoides y citocinas, que son liberadas por células heridas o infectadas. Los eicosanoides incluyen prostaglandinas que producen fiebre y dilatación de los vasos sanguíneos asociados con la inflamación, y leucotrienos que atraen ciertos leucocitos[16][17]
Las citocinas incluyen interleucinas que son responsables de la comunicación entre los leucocitos; chemokinas que promueven los chemotaxis; y las interferonas que tienen efectos anti-virales como la cancelación de la síntesis de proteínas en la célula huesped[18]
El factor de crecimiento y los factores citotóxicos pueden también ser liberados. Estas citocinas y otros químicos reclutan células inmunes al sitio de la infección y promueven la curación del tejido dañado con la remoción de los patógenos[19].
Sistema complementario
El sistema complementario es una cascada bioquímica que ataca las superficie de las células extrañas. Contiene más de 20 proteínas diferentes y complementa la destrucción de patógenos con anticuerpos. El sistema complementario es el mayor complemento humoral de una respuesta inmune innata[20][21]. Muchas especies tienen sistemas complementarios, el mismo no solo se presenta en los mamíferos, sino que las plantas, peces y algunos invertebrados también lo poseen[22].
En los seres humanos, esta respuesta es activada por inclusión de proteínas complementarias en carbohidratos en las superficies de los microorganismos o por la inclusión de complemento a anticuerpos que han atacado estos microorganismos. Esta señal de reconocimiento produce una rápida respuesta de destrucción[23]. La velocidad de la respuesta es resultado de la amplificación de la señal que ocurre tras la activación secuencial de las moléculas preolípticas del complemento, que también son peptidasas. Después las proteínas complementarias inicialmente atan al microorganismo, activando su actividad peptidasa.
Después de que las proteínas del complemento aten inicialmente al microbio, activan su actividad de peptidasa, que activa a su vez otras peptidasas complementarias, etcétera. Esto produce una cascada catalítica que amplifica la señal controlada por una reacción positiva[24]. La cascada resulta en la producción de peptidasa que atrae células inmunes, incrementa la permeabilidad vascular y cubre la superficie de un patógeno, marcándolo para su destrucción. Esta deposición del complemento puede también matar células directamente al bloquear la membrana de la plasma[20].
Barreras celulares de un sistema innato

Los leucocitos actúan como organismos unicelulares independientes y son la segunda arma del sistema inmune innato[5]. Los leucocitos innatos incluyen fagocitos (macrófagos, neutrófilos y células dendríticas), mastocitos, eosinófilos, basófilos y células naturales de destrucción. Estas células identifican y eliminan patógenos, atacando patógenos grandes a través del contacto o sumergiendo y entonces matando microorganismos[22]. Las células innatas también son importantes mediadores en la activación del sistema inmune adaptativo[3].
La Fagocitosis es una importante característica de la inmunidad innata celular realizada por células llamadas fagocitos, que sumergen o comen, patógenos y partículas. Los fagocitos generalmente patrullan en búsqueda de patógenos, pero pueden ser llamados a ubicaciones específicas por las citocinas[5] Una vez que el patógeno ha sido sumergido por el fagocito, es envuelto en una vesícula intracelular llamada Fagosoma. El patógeno es destruido por la actividad de las enzimas digestivas o sigue al chorro respiratorio que expulsa radicales libres en el fagolisosoma[25][26]. La fagocitosis ha evolucionado para adquirir nutrientes, pero este papel se extendió a los fagocitos para incluir el sumergimiento de patógenos como mecanismo de defensa[27] La fagocitosis probablemente representa la forma más antigua de defensa del huésped, pues ha sido identificada en animales vertebrados e invertebrados[28]
Los neutrófilos y macrófagos son fagocitos que viajan a través del cuerpo en persecución de los patógenos invasores[29]. Los neutrofilos son encontrados normalmente en la sangre y es el tipo más común de fagocitos, que normalmente representan el 50 o 60% del total de leucocitos que circulan en el cuerpo[30].
Durante la fase aguda de la inflamación, particularmente como resultado de la infección bacterial, los neutrófilos migran hacia el sitio de la inflamación en un proceso llamado chemotaxis, y son las primeras células en llegar a la escena de la infección. Los macrófagos son células versátiles que residen dentro de los tejidos y producen una amplia gama de arsenales químicos incluyendo las enzimas, las proteínas complementarias, y los factores reguladores como la interleucina[31]. Los macrófagos también actúan como limpiadores, librando el cuerpo de células muertas, y como células que contienen antígenos activan el sistema inmune adaptativo[3].
Las células dendríticas son fagocitos en los tejidos que están en contacto con el ambiente externo; por lo tanto están localizados principalmente en la piel, la nariz, los pulmones, el estomago y los intestinos.[32]. Se llaman así por su semejanza a las dendritas neuronales, pues ambas tienen muchas espinas proyectadas, pero las células dendríticas no están conectadas al sistema nervioso. Las células dendríticas como enlace entre los sistemas inmunes innato y adaptativo, pues presentan antígenos a las células T, una de las clases más importantes del sistema inmune adaptativo[32].
La gran mayoría reside en los tejidos conectivos y en las membranas mucosas, y regulan la respuesta inflamatoria[33]. Son las más asociadas con alergias y anafilaxia[30]. Los basófilos y los eosinófilos están relacionados a los neutrófilos. Ellas segregan mediadores químicos que están envueltos en la defensa contra parásitos y juegan un papel en las reacciones alérgicas, como el asma[34] Las células naturales asesinas son leucocitos que atacan y destruyen las células de los tumores, o células que han sido infectadas por un virus[35].
Inmunidad adaptativa
El sistema inmune adaptativo evolucionó hace poco en vertebrados y permite una respuesta inmunológica mayor, así como la capacidad denominada memoria inmunológica, donde cada patógeno es recordado por un antigeno[36]. La respuesta inmune adaptativa es específica de los antígenos y requiere el reconocimiento de antígenos que no son propios durante un proceso llamado presentación de los antígenos.
La especificidad del antígeno permite la generación de respuestas que se adaptan a patógenos específicos o a las células infectadas por patógenos. La habilidad de montar estas respuestas adaptadas es mantenidas en el cuerpo por las células de la memoria. Si un patógeno infecta un cuerpo más de una vez, estas células de memoria específicas se utilizan para eliminarlo rápidamente.
Linfocitos
Las células del sistema inmune adaptativo son una clase especial de leucotitos, llamados linfocitos. Las células B y las células T son clases importantes de linfocitos y son derivadas de las células madre en la médula ósea[22]. Las células B están involucradas en la respuesta inmune humoral, mientras que las células T están involucradas en la respuesta inmunitaria mediada por células.
Las células B y T contienen moléculas receptoras que reconocen objetivos específicos. Las células T reconocen un objetivo no-propio, como un patógeno, sólo después de que los antígenos (pequeños fragmentos del patógeno) han sido procesados y presentados en combinación con un receptor propio, llamado complejo mayor de histocompatibilidad. Hay dos subtipos mayores de células T: la célula T asesina y la célula T ayudante. Las células T asesinas solo reconocen antigenos acoplados a moléculas MHC clase I, mientras que las células T ayudantes sólo reconocen antigenos acoplados a moléculas MHC clase II. Estos dos mecanismos en que se presentan los antígenos reflejan los diferentes papeles de los dos tipos de células T. Un suptipo menor son las células T γ δ, que reconocen antígenos que no están acoplados a los receptores MHC[37].
En contraste, el receptor de antígenos específicos de las células B es un molécula de anticuerpos en la superficie de la célula B, y reconoce todos los patógenos sin la necesidad de un proceso.
Cada linaje de células B crea diferentes anticuerpos, así que el set completo de receptores de antígenos de las células B representan todos los anticuerpos que el cuerpo puede producir[22].
Células T asesinas
Las células T asesinas (llamados en ocasiones por su nombre en inglés: T natural killer) son un subgrupo de las células T que matan células infectadas con virus (y otros patógenos), o que de otra forma están dañadas o disfuncionales[39]. Como las células B, cada tipo de células T reconocen un antígeno diferente. Las células T asesinas son activadas cuando su receptor de células T (RCT) se enlaza a un antígeno específico en un complejo con el receptor MHC clase I de otra célula. El reconocimiento de este complejo MHC: antígeno es ayudado por un co-receptor en una célula T, llamado CD8. La célula T entonces viaja a través del cuerpo en búsqueda de células donde los receptores MHC clase I lleven este antígeno.
Cuando una célula T activada contacta con tales células libera citotoxinas que forman poros en la membrana de plasma de la célula objetivo, permitiendo que inones, agua y toxinas entren. Esto causa que la célula objetivo estalle o que experimente apoptosis[40]. La matanza que ocasionan las células T de células huésped es particularmente importante en la prevención de la reproducción de virus. La activación de las células T es altamente controlada y generalmente requiere una señal muy fuerte de activación por parte del complejo MHC/antígeno, u otra señal adicional de activación proveida por las células T ayudantes (ver abajo)[40].
Células T ayudantes
Las células T ayudantes regulan las respuestas inmunes innatas y adaptativas y ayudan a determinar que tipo de respuesta entregará el cuerpo a un patógeno en particular[41][42]. Estas células no tienen actividad citotóxica y no matan células infectadas o patógenos directamente. En cambio controlan la respuesta inmune, canalizando otras células para realizar esta actividad.
Las células T ayudantes crean receptores de células T que reconocen antígenos, limitándose a las moléculas MHC clase II. El complejo MHC:antígeno es también reconocido por co-receptor CD4, que recluta moléculas dentro de la célula T (e.j. Lck), las cuales son responsables de la activación de células T. Las células T ayudantes tienen una asociación más débil con el complejo MHC:antígeno que el que se observa entre las células T asesinas, lo que quiere decir que muchos receptores (alrededor de 200 a 300) en la célula T ayudante deben ser limitados por un MHC:antígeno para poder activar las células ayudantes, mientras que las células T asesinas pueden ser activadas por una molécula simple de un complejo MHV:antígeno.
La activación de células T ayudantes también requiere una duración más extensa de enlace con la célula que presenta el antígeno[43]. La activación de una célula T ayudante hace que esta libere citoquininas que influencia la actividad de muchos tipo de células. Las señales de la citoquinina producidas por las células T ayudantes realzan la función microbicida de los macrofagos y la actividad de las células T asesinas[5]. Además, las células T ayudantes causan una sobre-regulación de las moléculas expresadas en la superficie de las células T, como el ligando CD40 (también llamado CD154), que proveen señales extra de estimulación requeridas para activar los anticuerpos, que producen células B[44].
Células T γδ
Las células T γδ poseen un receptor de células T alternativo opuesto al de las células T CD4+ y CD8+ (αβ) y comparte características de las células T ayudantes, las células T citotóxicas y las células NK. Las condiciones que producen respuestas por parte de las células T γδ no son completamente entendidas. Al igual que otras células T 'no convencionales' que llevan los invariantes TCR, como la célula T asesina natural CD1d, las células T γδ están entre en medio de la inmunidad innata y adaptativa[45]. Por un lado, las células T γδ son un componente del sistema inmunológico adaptativo, pues ellas arreglan los genes TCR para producir diversos receptores y también desarrollar un fenotipo de memoria.
Por un lado, los diferentes subsets son también parte del sistema inmunológico innato, pues los receptores restringidos TCR y NK pueden ser usados como receptores de reconocimiento de patrones. Por ejemplo un gran número de células humanas T Vγ9/Vδ2 responden dentro de horas a moléculas comunes producidas por microbios, y las altamente restringidas células T Vδ1+ en el epitelio responderán a células epiteliales enfatizadas[46]
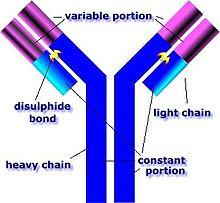
Anticuerpos y linfocitos B
Una célula B identifica patógenos cuando los anticuerpos en su superficie se enlazan a antígenos extranjeros específicos[47] . Este completo antígeno/anticuerpo es tomado por una célula B y procesado por proteólisis en los péptidos. La célula B entonces muestra estos antígenos péptidos en su superficie de moléculas MHC clase II. Esta combinación de MHC y antígenos atrae una célula T emparejada, que libera linfocitos y activa las células B[48].
Cuando la célula B ha sido activada entonces comienza a dividirse, su descendiente segrega millones de copias de un anticuerpo que reconoce este antígeno. Estos anticuerpos circulan en el plasma sanguíneo y el sistema linfático, llevando a los patógenos a segregar antígenos y a ser marcados para su destrucción por la activación del complemento. Los anticuerpos también pueden neutralizar desafíos directamente, llevando toxinas bacterianas o interfiriendo con los receptores que los virus y bacterias usan para infectar las células[49].
Sistema inmune adaptativo alternativo
Aunque las moléculas clásicas del sistema inmune adaptativo (por ejemplo, anticuerpos y receptores de células T) existen solamente en los vertebrados con mandíbula, una molécula distinta y derivada del linfocito ha sido descubierta en vertebrados sin mandíbula primitivos, como el lamprea y el myxinoidea. Estos animales poseen un gran número de moléculas llamadas linfocitos receptores variables (VLC) que, como los receptores antígenos de los vertebrados con mandíbula, son producidos por un número pequeño (uno o dos) de genes. Se cree que estas moléculas se enlazan de modo similar a los anticuerpos, con el mismo grado de especificidad[50].
Memoria inmunológica
Cuando las células B y las T son activadas y comienzan a replicarse, algunos de sus descendientes comienzan a volverse células de memoria con un largo periodo de vida. A través del tiempo de vida de un animal, estas células recordarán cada patógeno específico encontrado y pueden montar un fuerte respuesta si el patógeno es encontrado de nuevo. Esto es "adaptativo" porque ocurre durante el tiempo de vida de un individuo como una adaptación a una infección con ese patógeno y prepara al sistema inmunológico para futuros desafíos. La memoria inmunológica puede también ser pasiva y de corta duración o activa y de larga duración.
Memoria pasiva
La inmunidad pasiva es usualmente de corta duración, va de pocos días y algunos meses. Los recién nacidos no tienen exposición previa a los microbios y son particularmente vulnerables a una infección. Muchas de las capas de protección pasiva son provistas por la madre. Durante el embarazo, un particular tipo de anticuerpo, llamado IgG, es transportado de la madre al bebé directamente por la placenta, así los bebés humanos tienen altos niveles de anticuerpos inclusive al nacer[51]. La leche materna también contiene anticuerpos que son transferidos a las tripas del infante para protegerlo de infecciones bacterianas hasta que este pueda sintetizar sus propios anticuerpos[52].
Esto es inmunidad pasiva porque el feto en realidad no puede crear células de memoria o anticuerpos, sólo los toma prestados de la madre. En la medicina, la inmunidad protectiva pasiva puede ser también transferida artificialmente de un individuo a otro a través de suero rico en anticuerpos.[53]

Memoria activa e inmunización
La memoria activa de larga duración es adquirida después de la infección por la activación de las células T y B. La inmunidad activa puede ser también generada artificialmente, a través de la vacunación. El principio detrás de la vacunación (también llamada inmunización) es introducir un antígeno desde un patógeno para estimular el sistema inmunológico y desarrollar inmunidad específica contra ese patógeno particular sin causar enfermedades con ese organismo[5].
Esta deliberada inducción de una respuesta inmune es exitosa porque explota la especificidad natural del sistema inmunológico, así como su inductibilidad. Con la enfermedad contagiosa como una de las causas más frecuentes de muerte en la población humana, la vacunación representa la manipulación más efectiva del sistema inmunológico que se ha desarrollado[54][22].
Casi todas las vacunas virales están basadas en virus vivos atenuados, mientras que las vacunas bacterianas están basadas en componentes no-celulares de micro-organismos, incluyendo componentes de toxinas inofensivas[5]. Desde que muchos antígenos derivados de vacunas acelulares no inducen fuertemente la respuesta adaptativa, la gran mayoría de vacunas son despachadas con coadyuvantes que activan las células que tienen antígenos del sistema innato inmune y maximiza la inmunodeficiencia[55].
Desórdenes en la inmunidad humana
El sistema inmunológico es una notable y efectiva estructura que incorpora especificidad, inducibilidad y adaptación. Es posible que la defensa del huésped falle, y cuando esto ocurre se pueden clasificar en 3 casos concretos: inmunodeficiencias, autoinmunidad e hipersensibilidades.
Inmunodeficiencias
La Inmunodeficiencia ocurre cuando uno o más de los componentes del sistema inmunológico están inactivos. La habilidad del sistema inmunológico de responder a los patógenos se disminuye en los jóvenes y en los adultos mayores. En estos últimos las inmunorespuestas empiezan a decaer alrededor de los 50 años[56].
En países desarrollados, la obesidad, el alcoholismo y el abuso de drogas ilegales son causas comunes de un pobre sistema inmune[56]. Sin embargo, la malnutrición es la causa más común de la inmunodeficiencia en países desarrollados.[56].
Las inmunodeficiencias también pueden ser heredadas o adquiridas[5]. En la enfermedad granulomatosa crónica, en la cual los fagocitos tienen problemas al destruir patógenos, es un ejemplo de una herencia, o inmunodeficiencia congénita. El SIDA y algunos tipos de cáncer causan inmunodeficiencia adquirida[57][58].
Autoinmunidad
Las inmunorespuestas abarcan el otro extremo de la disfunción inmune, particularmente el desorden autoinmune. Aquí el sistema inmune falla al distinguirse a sí mismo, y ataca parte del cuerpo. Bajo circunstancias normales, muchas células T y anticuerpos reaccionan con sus propios péptidos[59]. Una de las funciones de las células especializadas (localizadas en el timo y en la médula ósea) es presentar linfocitos jóvenes con antígenos propios producidos a través del cuerpo y eliminar estas células que reconocen antígenos propios, previniendo la autoinmunidad[47].
Hipersensibilidad
La hipersensibilidad es una inmunorespuesta que daña los tejidos propios del cuerpo. Está dividida en cuatro clases (Tipo I-IV) basándose en los mecanismos involucrados y el tiempo de curso de la reacción hipersensible. El tipo I de hipersensibilidad es una inmediata o anafiláxica, relacionada con alergias. Los síntomas van desde un malestar suave hasta la muerte. El tipo I de hipersensibilidad es regulado por la inmunoglobulina E, que es liberada por mastocitos y basófilos[60].
El tipo II de hipersensibilidad ocurre cuando los anticuerpos se emparejan en los antígenos de las células propias de un paciente, marcándolas para su destrucción. Esto es llamado dependencia de anticuerpos o hipersensibilidad, y es mediado por los anticuerpos de la inmunoglobina G y la inmunoglobina I[60].
Los complejos inmunológicos (emparejamiento de antígenos, proteínas de complemento, y anticuerpos IgG y IgM) depositan en varios tejidos reacciones hipersensibles de tipo III[60]. La hipersensibilidad de tipo IV (también conocida como "hipersensibilidad de tipo retrasado") usualmente toma entre dos y tres días para desarrollarse. Las reacciones de tipo IV están envueltas en enfermedades autoinmunes e infecciosas, pero también incluyen dermatitis de contacto. Estas reacciones son mediadas por las células T, los monocitos y los macrófagos[60].
Otros mecanismos de defensa del huésped
Es probable que un sistema inmune de varios componentes y adaptativo se haya hecho presente en los primeros vertebrados, y que otras especies no hayan generado linfocitos o anticuerpos basados en una respuesta humoral[1]. Muchas especies, sin embargo, utilizan mecanismos que parecen ser precursores de estos aspectos de la inmunidad de los vertebrados.
Los sistemas inmunológicos aparecen inclusive hasta en las formas de vida más simples estructuralmente, con las bacterias usando un único mecanismo de defensa, llamado "sistema de restricción de modificaciones" para protegerse de patógenos virales, llamados bacteriófagos[61].
Los receptores de reconocimiento de patrones son proteínas usadas por casi todos los organismos para identificar moléculas relacionadas con patógenas microbiales. Los péptidos antimicrobiales llamados defensinas son un componente evolucionario conservado de la respuesta inmune innata encontrada en todas las plantas y animales, y representan la forma principal la inmunidad sistemática de todos los invertebrados[1]. El sistema complementario y las células fagocitarias son también utilizadas por la mayoría de las formas de vida invertebrada.
El camino de los ribonucleosos y la interferencia del RNA son conservados a través de todos los eucariotes, y se piensa que juegan un papel en la inmunorespuesta a los virus y otro material genético extraño[62].
A diferencia de los animales, las plantas carecen de células fagocitarias, y la gran mayoría de las respuestas inmunológicas de estos seres involucran señales sistemáticas químicas que son enviadas a través de la planta[63]. Cuando una parte de la planta se infecta, la planta produce una respuesta hipersensible localizada, por medio de la cual las células en el sitio de la infección sufren de una rápida apoptosis con el fin de prevenir la dispersión de la enfermedad a otras partes de la planta.
La resistencia adquirida sistemática (RAS) es un tipo de respuesta defensiva usada por las plantas que rinde resistencia entera a agentes infecciosos particulares[63]. Los mecanismos de silenciamiento del RNA son particularmente importantes en esta respuesta sistemática, pues pueden bloquear replicaciones de los virus[64].
Inmunología de tumores

Otro papel importante del sistema inmunológico es identificar y eliminar tumores. Las células transformadas de los tumores generan antígenos que no son encontrados en células normales. En el sistema inmune, estas antígenos aparecen como extranjeros, y su presencia causa que las células inmunes ataquen a las células transformadas por el tumor. Los antígenos generados por los tumores tienen muchas fuentes[66]; algunos son derivadas de virus oncogénicos como el Papiloma humano, que causa cáncer cervical[67] mientras que otros son proteínas propias del organismos que ocurren a bajos niveles en células normales, pero que alcanzan altos niveles en células con tumores. Un ejemplo es una enzima llamada tirosinase que, cuando genera altos niveles, transforma ciertos recubrimientos de las células en tumores llamados melanomas[68][69]. Una tercera causa de antígenos de tumores son proteínas normalmente importantes para el crecimiento y la supervivencia de las células, que comúnmente se mutan con cáncer induciendo unas moléculas llamadas oncógenos[66][70][71].
La principal respuesta del sistema inmunológico es destruir las células anormales usando células T asesinas, algunas veces con asistencia de las células T ayudantes[69][72] Los antígenos de tumor se presentanen moléculas MHC clase 1 en una forma similar a los antígenos virales. Esto permite a las células T asesinas reconocer a la célula de tumor como anormal.[73]. Las células NK también matan células de tumor en una forma similar, especialmente si la célula de tumor tiene moléculas por debajo de clase I del MHC de lo normal, en su superficie; este fenómeno es común con los tumores[74] Algunas veces los anticuerpos son generados contra las células de tumor permitiendo su destrucción mediante el sistema complementario[70].
Es claro que algunos tumores evaden al sistema inmunológico y se convierten en cáncer[75]. Un mecanismo usado por las células de tumor para evadir la detección por parte de células T asesinas es reducir el número de moléculas MHC clase I en su superficie[73].
Algunas células de tumor también liberan productos que inhiben la respuesta inmune, por ejemplo al secretar la citocima TGF-β, la cual suprime la actividad de los macrófagos y linfocitos[76].
Además, la tolerancia inmunológica puede se puede desarrollar contra los antígenos del tumor, así el sistema inmune no atacará las células del tumor[75].
Regulación fisiológica
Las hormonas pueden modular la sensibilidad del sistema inmunológico. Por ejemplo, las hormonas sexuales femeninas son conocidas por estimular el sistema inmunológico innato[77] como adaptativo[78].
Algunas enfermedades autoinmunes como el lupus eritematoso golpean preferiblemente a las mujeres,y su comienzo coincide muy seguido con la pubertad.
Por el contrario, andrógenos como la testosterona parece que suprimen el sistema inmunológico[79]. Otras hormonas también parece que regulan el sistema inmunológico, como la prolactina, la hormona de crecimiento y la vitamina D[80][81].
Se piensa que un descenso progresivo en los niveles de hormona con la edad es parcialmente responsable de respuestas inmunitarias debilitadas en individuos de edad avanzada[82]. Controversialmente, algunas hormonas son reguladas por el sistema inmunitario, sobre todo la actividad de la hormona de la tiroides[83].
El sistema inmunológico es realzado por el sueño y el descanso[84], y es desparejado por el estrés[85].
Las dietas pueden afectar el sistema inmunológico; por ejemplo frutas frescas, vegetales y comida rica en ciertos ácidos grasos pueden afectar un sistema inmunológico saludable[86].Asimismo, la desnutrición fetal puede causar una debilitación de por vida del sistema inmune[87].
En las medicinas tradicionales, se cree que algunas hierbas pueden estimular el sistema inmunológico. Estudios han sugerido que esas hierbas pueden de hecho estimular el sistema inmunológico[88] aunque su modo de acción es complejo y difícil de caracterizar.
Manipulación en la medicina
La respuesta inmunológica puede ser manipulada para suprimir respuestas no deseadas de la autoinmunidad, y el rechazo de trasplantes, así como para estimulares respuestas protectoras contra patógenos que constantemente evaden el sistema inmunológico.
Las drogas inmunodepresivas son usadas para controlar desordenes autoinmunes de inflamación cuando ocurren grandes daños a los tejidos, o para prevenir el rechazo de un órgano trasplantado[22][89].
Las drogas anti-inflamatorias son usadas para controlar los efectos de la inflamación. Los corticosteroides son las más poderosas de estas drogas; sin embargo, estas tienen mucho efectos tóxicos colaterales y su uso debe ser controlado[90].
Por lo tanto, dosis más bajas de drogas anti-inflamatorias son usadas a menudo en conjunto con drogras inmunodepresivas y citotóxicas como el metotrexato o azatioprina. Las drogas citotóxicas inhiben la inmunorespuesta destruyendo células como las células T que han sido activadas. Sin embargo, la destrucción es indiscriminada, por lo que otros órganos y tipos de células están afectadas, lo que causa efectos colaterales[89]. Las drogas inmunodepresivas como la ciclosporina previenen a las células T de responder correctamente las señales inhiben los caminos de transducción de las señales[91].
Drogas más pesadas (> Da) pueden provocar una neutralización de la respuesta inmune, particularmente si son suministradas repetidamente, o en dosis grandes. Este limite de efectividad de drogas basados en péptidos más largos y proteínas (que son más grande que 6000 Da). En algunos casos, la droga no es en sí inmunogenética, pero puede ser co-administrada con un componente inmunogenético, como es el caso del Taxol. Métodos computacionales han sido desarrollados para predecir la inmunogenicidad de péptidos y proteínas, que son particularmente útiles en el diseño de anticuerpos terapéuticos.
Técnicas recientes confían principalmente en que los aminoácidos hidrofílicos están más presente en los epítopes que los aminoácidos hidrofóbicos[92]; sin embargo, recientemente se confía en las técnicas de "aprendizaje de máquinas" que usan bases de datos de conocidos epítopes, usualmente bien estudiadas proteínas de virus, como un campo de entrenamiento[93].
Se ha establecido una base de datos pública para catalogar epítomas de patógenos que se sabe son reconocidos por células B.[94] El campo emergente de los estudios basados en la bioinformática de inmunogenética es conocido como inmunoinformática.[95]
Manipulación por los patógenos
El éxito de cualquier patógeno depende de su habilidad para eludir las respuestas inmunitarias del huésped. Por ello, los patógenos han desarrollado diferentes métodos que permiten infectar exitosamente a un huésped, al mismo tiempo que evaden la destrucción producida por la inmunidad.[96] Las bacterias frecuentemente logran sobrepasar las barreras físicas al secretar enzimas que digieren la barrera – por ejemplo, utilizando un sistema de secreción de tipo II.[97] Alternativamente, la usar un sistema de secreción tipo III, pueden insertar un tubo de vacío en la célula huésped que le provee de un conducto para mover proteínas del patógeno al huésped; las proteínas transportadas por el tubo son utilizadas frecuentemente para desarmar las defensas del huésped.[98]
Una estrategia utilizada por varios patógenos para darle la vuelta al sistema inmune innato es la replicación intracelular (también llamada patogénesis intracelular). En ella, un patógeno pasa la mayor parte de su ciclo de vida dentro de células huésped en donde se protege del contacto directo con células inmunitarias, anticuerpos y complementos. Algunos ejemplos de patógenos intracelulares incluyen los virus, el envenenamiento alimenticio bacterial de la Salmonela y los parásitos eukarióticos que causan lamalaria (Plasmodium falciparum) y Leishmaniasis (Leishmania spp.). Otras bacterias, como la Mycobacterium tuberculosis, viven dentro de una capa protectora que evita la lisis por complemento.[99] Muchos patógenos secretan componentes que disminuyen la respuesta inmunitaria del huésped.[96] Algunas bacterias forman biopelículas para protegerse de las células y proteinas del sistema inmunitario. Estas biopelículas están presentes en muchas infecciones exitosas, como por ejemplo las infecciones Pseudomonas aeruginosa y Burkholderia cenocepacia características de la Fibrosis quística.[100] Otras bacterias generan proteínas de superficie que conectan con anticuerpos, haciéndolos inefectivos; ejemplos incluyen los estreptococos (proteína G), estafilococos (proteína A), y Peptostreptococos (proteína L).[101]
Los mecanismos empleados por los virus para evadir el sistema inmune adaptativo son más complicados. El enfoque más sencillo es el de cambiar rápidamente epítopes no esenciales (Aminoácidos o azúcares) en la superficie del invasor, mientras se mantienen los los opítopes esenciales camuflados. El VIH, por ejemplo, muta regularmente las proteínas de su envoltorio viral que le son esenciales para entrar en las células huésped que son su objetivo. Estos cambios frecuentes en antígenos pueden explicar el no haber logrado producir vacunas dirigidas contra estas proteínas.[102] Otra estrategia común en los antígenos para evitar ser detectados por el sistema inmunitario consiste en disfrazarse con moléculas del huésped. En el HIV, el envoltorio que cubre el virus está formado por la membrana más externa de la célula huésped; tales virus "auto-camuflados" dificultan que el sistema inmunitario los identifique como células no propias.[103]
Historia de la inmunología
La Immunología es una ciencia que examina la estructura y función del sistema inmunológico. Se origina en la medicina y los primeros estudios sobre las causas de la inmunidad a enfermedades. La referencia más antigua a la inmunidad es durante la plaga de Atenas en el 430 adC. Tucídides notó que algunas personas que se habían recuperado de un brote anterior de la enfermedad podían atender a los enfermos sin contraer la enfermedad por segunda vez.[104] Esta observación de inmunidad adquirida fue luego utilizada por Louis Pasteur en el desarrollo de la vacunación y en su Teoría de gérmenes de las enfermedades infecciosas.[105] La teoría de Pasteur iba en contra de las teorías contemporáneas sobre las enfermedades, tales como la Teoría miasmática. Recién en 1891 cuando Robert Koch propuso sus postulados, por los que recibió el Premio Nobel en 1905, se confirmó que los microorganismos son la causa de las enfermedades infecciosas.[106] En 1901, con el descubrimiento del virus de la fiebre amarilla por Walter Reed, se confirmó que los virus son patógenos humanos.[107]
La inmunología realizó un gran avance hacia el final del siglo XIX, debido a los rápidos desarrollos en el estudio de la inmunología humoral e inmunología celular.[108] De particular importancia fue el trabajo de Paul Ehrlich, quien propuso la Teoría de la cadena lateral para explicar la especificidad de la reacción antígeno-anticuerpo; sus contribuciones al entendimiento de la inmunología humoral fueron reconocidos con el Premio Nobel en 1908, recibido en conjunto con Elie Metchnikoff, el fundador de la inmunología celular.[109]
Véase también
 Wikimedia Commons alberga una categoría multimedia sobre Sistema inmunitario.
Wikimedia Commons alberga una categoría multimedia sobre Sistema inmunitario.- Apoptosis
- Selección clonal
- Epítope
- Hapteno
- Inmunoestimulador
- Inmunoterapia
- Principales sistemas del cuerpo humano
- Anticuerpos monoclonales
- Pecado original antigénico
- Anticuerpo policlonal
- Antígenos
Referencias
- ↑ a b c Beck, Gregory; Gail S. Habicht (noviembre de 1996). «Immunity and the Invertebrates[[Categoría:Wikipedia:Artículos con texto en inglés]]» (PDF). Scientific American: 60-66. Consultado el 1 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ a b Litman G, Cannon J, Dishaw L (2005). «Reconstructing immune phylogeny: new perspectives.». Nat Rev Immunol 5 (11): 866-79. PMID 16261174.
- ↑ a b c Mayer, Gene (2006). «Immunology - Chapter One: Innate (non-specific) Immunity[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado el 1 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ Smith A.D. (Ed) Oxford dictionary of biochemistry and molecular biology. (1997) Oxford University Press. ISBN 0-19-854768-4
- ↑ a b c d e f g h i Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition[[Categoría:Wikipedia:Artículos con texto en inglés]]. New York and London: Garland Science. ISBN 0-8153-3218-1. Wikienlace dentro del título de la URL (ayuda)
- ↑ Boyton R, Openshaw P. «Pulmonary defences to acute respiratory infection.». Br Med Bull 61: 1-12. PMID 11997295.
- ↑ Agerberth B, Gudmundsson G. «Host antimicrobial defence peptides in human disease.». Curr Top Microbiol Immunol 306: 67-90. PMID 16909918.
- ↑ Moreau J, Girgis D, Hume E, Dajcs J, Austin M, O'Callaghan R (2001). «Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus[[Categoría:Wikipedia:Artículos con texto en inglés]].». Invest Ophthalmol Vis Sci 42 (10): 2347-54. PMID 11527949. Wikienlace dentro del título de la URL (ayuda)
- ↑ Hankiewicz J, Swierczek E (1974). «Lysozyme in human body fluids.». Clin Chim Acta 57 (3): 205-9. PMID 4434640.
- ↑ Fair W, Couch J, Wehner N (1976). «Prostatic antibacterial factor. Identity and significance.». Urology 7 (2): 169-77. PMID 54972.
- ↑ Yenugu S, Hamil K, Birse C, Ruben S, French F, Hall S (2003). «Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli[[Categoría:Wikipedia:Artículos con texto en inglés]].». Biochem J 372 (Pt 2): 473-83. PMID 12628001. Wikienlace dentro del título de la URL (ayuda)
- ↑ Gorbach S (1990). «Lactic acid bacteria and human health». Ann Med 22 (1): 37 - 41. PMID 2109988.
- ↑ Hill L, Embil J (1986). «Vaginitis: current microbiologic and clinical concepts[[Categoría:Wikipedia:Artículos con texto en inglés]].». CMAJ 134 (4): 321-31. PMID 3510698. Wikienlace dentro del título de la URL (ayuda)
- ↑ Salminen S, Gueimonde M, Isolauri E (2005). «Probiotics that modify disease risk[[Categoría:Wikipedia:Artículos con texto en inglés]]». J Nutr 135 (5): 1294 - 8. PMID 15867327. Wikienlace dentro del título de la URL (ayuda)
- ↑ Kawai T, Akira S (2006). «Innate immune recognition of viral infection». Nat Immunol 7 (2): 131-7. PMID 16424890.
- ↑ Miller, SB (2006). «Prostaglandins in Health and Disease: An Overview». Seminars in Arthritis and Rheumatism 36 (1): 37-49. PMID 16887467.
- ↑ Ogawa Y, Calhoun WJ. (2006). «The role of leukotrienes in airway inflammation.». J Allergy Clin Immunol. 118 (4): 789-98. PMID 17030228.
- ↑ Le Y, Zhou Y, Iribarren P, Wang J (2004). «Chemokines and chemokine receptors: their manifold roles in homeostasis and disease[[Categoría:Wikipedia:Artículos con texto en inglés]]». Cell Mol Immunol 1 (2): 95-104. PMID 16212895. Wikienlace dentro del título de la URL (ayuda)
- ↑ Martin P, Leibovich S (2005). «Inflammatory cells during wound repair: the good, the bad and the ugly.». Trends Cell Biol 15 (11): 599-607. PMID 16202600.
- ↑ a b Rus H, Cudrici C, Niculescu F (2005). «The role of the complement system in innate immunity.». Immunol Res 33 (2): 103-12. PMID 16234578.
- ↑ Mayer, Gene (2006). «Immunology - Chapter Two: Complement[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado el 1 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ a b c d e f Janeway CA, Jr. et al (2005). Immunobiology. (6th ed. edición). Garland Science. ISBN 0-443-07310-4.
- ↑ Liszewski M, Farries T, Lublin D, Rooney I, Atkinson J. «Control of the complement system.». Adv Immunol 61: 201-83. PMID 8834497.
- ↑ Sim R, Tsiftsoglou S (2004). «Proteases of the complement system[[Categoría:Wikipedia:Artículos con texto en inglés]].». Biochem Soc Trans 32 (Pt 1): 21-7. PMID 14748705. Wikienlace dentro del título de la URL (ayuda)
- ↑ Ryter A (1985). «Antimicrobial functions of mononuclear phagocytes». Comp Immunol Microbiol Infect Dis 8 (2): 119-33. PMID 3910340.
- ↑ Langermans J, Hazenbos W, van Furth R (1994). «Antimicrobial functions of mononuclear phagocytes». J Immunol Methods 174 (1-2): 185-94. PMID 8083520.
- ↑ May R, Machesky L (2001). «Phagocytosis and the actin cytoskeleton[[Categoría:Wikipedia:Artículos con texto en inglés]]». J Cell Sci 114 (Pt 6): 1061-77. PMID 11228151. Wikienlace dentro del título de la URL (ayuda)
- ↑ Salzet M, Tasiemski A, Cooper E (2006). «Innate immunity in lophotrochozoans: the annelids». Curr Pharm Des 12 (24): 3043-50. PMID 16918433.
- ↑ Zen K, Parkos C (2003). «Leukocyte-epithelial interactions». Curr Opin Cell Biol 15 (5): 557-64. PMID 14519390.
- ↑ a b Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín (1995). Inflammation and Fever from Pathophysiology: Principles of Disease[[Categoría:Wikipedia:Artículos con texto en inglés]]. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. Consultado el 1 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ Bowers, William (2006). «Immunology -Chapter Thirteen: Immunoregulation[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado el 4 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ a b Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S. «Antigen presentation and T cell stimulation by dendritic cells». Annu Rev Immunol 20: 621-67. PMID 11861614.
- ↑ Krishnaswamy G, Ajitawi O, Chi D. «The human mast cell: an overview.». Methods Mol Biol 315: 13-34. PMID 16110146.
- ↑ Kariyawasam H, Robinson D (2006). «The eosinophil: the cell and its weapons, the cytokines, its locations». Semin Respir Crit Care Med 27 (2): 117-27. PMID 16612762.
- ↑ Middleton D, Curran M, Maxwell L (2002). «Natural killer cells and their receptors». Transpl Immunol 10 (2-3): 147-64. PMID 12216946.
- ↑ Pancer Z, Cooper M. «The evolution of adaptive immunity». Annu Rev Immunol 24: 497-518. PMID 16551257.
- ↑ Holtmeier W, Kabelitz D. «gammadelta T cells link innate and adaptive immune responses». Chem Immunol Allergy 86: 151-83. PMID 15976493.
- ↑ a b «Understanding the Immune System: How it Works» (PDF). National Institute of Allergy and Infectious Diseases (NIAID). Consultado el 1 de enero de 2007.
- ↑ Harty J, Tvinnereim A, White D. «CD8+ T cell effector mechanisms in resistance to infection». Annu Rev Immunol 18: 275-308. PMID 10837060.
- ↑ a b Radoja S, Frey A, Vukmanovic S (2006). «T-cell receptor signaling events triggering granule exocytosis». Crit Rev Immunol 26 (3): 265-90. PMID 16928189.
- ↑ Abbas A, Murphy K, Sher A (1996). «Functional diversity of helper T lymphocytes». Nature 383 (6603): 787-93. PMID 8893001.
- ↑ McHeyzer-Williams L, Malherbe L, McHeyzer-Williams M. «Helper T cell-regulated B cell immunity». Curr Top Microbiol Immunol 311: 59-83. PMID 17048705.
- ↑ Kovacs B, Maus M, Riley J, Derimanov G, Koretzky G, June C, Finkel T (2002). «Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation[[Categoría:Wikipedia:Artículos con texto en inglés]]». Proc Natl Acad Sci U S A 99 (23): 15006-11. PMID 12419850. Wikienlace dentro del título de la URL (ayuda)
- ↑ Grewal I, Flavell R. «CD40 and CD154 in cell-mediated immunity». Annu Rev Immunol 16: 111-35. PMID 9597126.
- ↑ Girardi M (2006). «Immunosurveillance and immunoregulation by γδ T cells». J Invest Dermatol 126 (1): 25-31. PMID 16417214.
- ↑ Holtmeier W, Kabelitz D (2005). «γδ T cells link innate and adaptive immune responses». Chem Immunol Allergy 86: 151-183. PMID 15976493.
- ↑ a b Sproul T, Cheng P, Dykstra M, Pierce S (2000). «A role for MHC class II antigen processing in B cell development». Int Rev Immunol 19 (2-3): 139-55. PMID 10763706.
- ↑ Kehry M, Hodgkin P (1994). «B-cell activation by helper T-cell membranes». Crit Rev Immunol 14 (3-4): 221-38. PMID 7538767.
- ↑ Bowers, William (2006). «Immunology - Chapter nine: Cells involved in immune responses[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado el 4 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ M.N. Alder, I.B. Rogozin, L.M. Iyer, G.V. Glazko, M.D. Cooper, Z. Pancer (2005). «Diversity and Function of Adaptive Immune Receptors in a Jawless Vertebrate». Science 310 (5756): 1970 - 1973. PMID 16373579.
- ↑ Saji F, Samejima Y, Kamiura S, Koyama M (1999). «Dynamics of immunoglobulins at the feto-maternal interface[[Categoría:Wikipedia:Artículos con texto en inglés]].». Rev Reprod 4 (2): 81-9. PMID 10357095. Wikienlace dentro del título de la URL (ayuda)
- ↑ Van de Perre P (2003). «Transfer of antibody via mother's milk.». Vaccine 21 (24): 3374-6. PMID 12850343.
- ↑ Keller, Margaret A. and E. Richard Stiehm (2000). «Passive Immunity in Prevention and Treatment of Infectious Diseases[[Categoría:Wikipedia:Artículos con texto en inglés]].». Clinical Microbiology Reviews 13 (4): 602-614. PMID 11023960. Wikienlace dentro del título de la URL (ayuda)
- ↑ Death and DALY estimates for 2002 by cause for WHO Member States. World Health Organization. Visitado el 1 de enero de 2007.
- ↑ Singh M, O'Hagan D (1999). «Advances in vaccine adjuvants». Nat Biotechnol 17 (11): 1075-81. PMID 10545912.
- ↑ a b c Chandra, RK (1997). «Nutrition and the immune system: an introduction[[Categoría:Wikipedia:Artículos con texto en inglés]]». American Journal of Clinical Nutrition. Vol 66: 460S-463S. PMID 9250133. Wikienlace dentro del título de la URL (ayuda) Texto completo disponible en pdf
- ↑ Joos L, Tamm M (2005). «Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy[[Categoría:Wikipedia:Artículos con texto en inglés]]». Proc Am Thorac Soc 2 (5): 445-8. PMID 16322598. Wikienlace dentro del título de la URL (ayuda)
- ↑ Copeland K, Heeney J (1996). «T helper cell activation and human retroviral pathogenesis[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiol Rev 60 (4): 722-42. PMID 8987361. Wikienlace dentro del título de la URL (ayuda)
- ↑ Miller J (1993). «Self-nonself discrimination and tolerance in T and B lymphocytes». Immunol Res 12 (2): 115-30. PMID 8254222.
- ↑ a b c d Ghaffar, Abdul (2006). «Immunology - Chapter Seventeen: Hypersensitivity Reactions[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado el 1 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ Bickle T, Krüger D (1993). «Biology of DNA restriction[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiol Rev 57 (2): 434-50. PMID 8336674. Wikienlace dentro del título de la URL (ayuda)
- ↑ Stram Y, Kuzntzova L. (2006). «Inhibition of viruses by RNA interference». Virus Genes 32 (3): 299-306. PMID 16732482.
- ↑ a b Schneider, David (Spring 2005). «Innate Immunity - Lecture 4: Plant immune responses[[Categoría:Wikipedia:Artículos con texto en inglés]]». Stanford University Department of Microbiology and Immunology. Consultado el 1 de enero de 2007. Wikienlace dentro del título de la URL (ayuda)
- ↑ Baulcombe D (2004). «RNA silencing in plants». Nature 431 (7006): 356-63. PMID 15372043.
- ↑ Morgan R et al. (2006). «Cancer regression in patients after transfer of genetically engineered lymphocytes». Science 314: 126-129. PMID 16946036.
- ↑ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (2006). «Cytotoxic T cells». J Invest Dermatol 126 (1): 32-41. PMID 16417215.
- ↑ Boon T, van der Bruggen P (1996). «Human tumor antigens recognized by T lymphocytes». J Exp Med 183: 725-29. PMID 8642276.
- ↑ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G (2000). «T cell recognition of melanoma-associated antigens». J Cell Physiol 182: 323-31. PMID 10653598.
- ↑ a b Romero P, Cerottini JC, Speiser DE (2006). «The human T cell response to melanoma antigens». Adv Immunol. 92: 187-224. PMID 17145305.
- ↑ a b Guevara-Patino JA, Turk MJ, Wolchok JD, Houghton AN (2003). «Immunity to cancer through immune recognition of altered self: studies with melanoma». Adv Cancer Res. 90: 157-77. PMID 14710950.
- ↑ Renkvist N, Castelli C, Robbins PF, Parmiani G (2001). «A listing of human tumor antigens recognized by T cells». Cancer Immunol Immunother 50: 3-15. PMID 11315507.
- ↑ Gerloni M, Zanetti M. (2005). «CD4 T cells in tumor immunity». . Springer Semin Immunopathol 27 (1): 37-48. PMID 15965712.
- ↑ a b Seliger B, Ritz U, Ferrone S (2006). «Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation». Int J Cancer 118 (1): 129-38. PMID 16003759.
- ↑ Hayakawa Y, Smyth MJ. (2006). «Innate immune recognition and suppression of tumors». Adv Cancer Res 95: 293-322. PMID 16860661.
- ↑ a b Seliger B (2005). «Strategies of tumor immune evasion». BioDrugs 19 (6): 347-54. PMID 16392887.
- ↑ Frumento G, Piazza T, Di Carlo E, Ferrini S (2006). «Targeting tumor-related immunosuppression for cancer immunotherapy». Endocr Metab Immune Disord Drug Targets 6 (3): 233-7. PMID 17017974.
- ↑ Wira, CR; Crane-Godreau M, Grant K (2004). «Endocrine regulation of the mucosal immune system in the female reproductive tract». En In: Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.), ed. Mucosal Immunology. San Francisco: Elsevier. ISBN 0124915434.
- ↑ Lang, TJ (2004). «Estrogen as an immunomodulator». Clin Immunol 113: 224–230. PMID 15507385.
Moriyama, A; Shimoya K, Ogata I et al. (1999). «Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle[[Categoría:Wikipedia:Artículos con texto en inglés]]». Molecular Human Reproduction 5: 656–661. PMID 10381821. Wikienlace dentro del título de la URL (ayuda)
Cutolo, M; Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). «Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity». Lupus 13: 635–638. PMID 15485092.
King, AE; Critchley HOD, Kelly RW (2000). Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial role[[Categoría:Wikipedia:Artículos con texto en inglés]] 6. pp. 191–196. PMID 10655462. Wikienlace dentro del título de la URL (ayuda) - ↑ Fimmel; Zouboulis CC (2005). «Influence of physiological androgen levels on wound healing and immune status in men». Aging Male 8: 166–174. PMID 16390741. Parámetro desconocido
|fist=ignorado (ayuda); - ↑ Dorshkind, K; Horseman ND (2000). «The Roles of Prolactin, Growth Hormone, Insulin-Like Growth Factor-I, and Thyroid Hormones in Lymphocyte Development and Function: Insights from Genetic Models of Hormones and Hormone Receptor Deficiency[[Categoría:Wikipedia:Artículos con texto en inglés]]». Endocrine Reviews 21: 292–312. PMID 10857555. Wikienlace dentro del título de la URL (ayuda)
- ↑ Nagpal, Sunil; Songqing Naand and Radhakrishnan Rathnachalam (2005). «Noncalcemic Actions of Vitamin D Receptor Ligands[[Categoría:Wikipedia:Artículos con texto en inglés]]». Endocrine Reviews 26 (5): 662–687. PMID 15798098. Wikienlace dentro del título de la URL (ayuda)
- ↑ Hertoghe, T (2005). «The “multiple hormone deficiency” theory of aging: Is human senescence caused mainly by multiple hormone deficiencies?». Annals of the New York Academy of Science 1051: 448–465. PMID 16399912.
- ↑ Klein, JR (2006). «The immune system as a regulator of thyroid hormone activity». Exp Biol Med 231: 229–236. PMID 16514168.
- ↑ Lange, T; Perras B, Fehm HL, Born J (2003). «Sleep Enhances the Human Antibody response to Hepatitis A Vaccination[[Categoría:Wikipedia:Artículos con texto en inglés]]». Psychosomatic Medicine 65: 831–835. PMID 14508028. Wikienlace dentro del título de la URL (ayuda)
- ↑ Khansari, DN; Murgo AJ, Faith RE (1990). «Effects of stress on the immune system». Immunology Today 11: 170–175. PMID 2186751.
- ↑ Pond, CM (2005). «Adipose tissue and the immune system». Prostaglandins, Leukotrienes, and Essential Fatty Acids 73: 17-30. PMID 15946832.
- ↑ Langley-Evans, SC; Carrington LJ (2006). «Diet and the developing immune system». Lupus 15: 746–752. PMID 17153845.
- ↑ Spelman, K; Burns J, Nichols D, Winters N, Ottersberg S, Tenborg M (2006). «Modulation of cytokine expression by traditional medicines: a review of herbal immunomodulators». Alternative Medicine reviews: 128–150. PMID 16813462. Texto « volume 11 » ignorado (ayuda)
Brush, J; Mendenhall E, Guggenheim A, Chan T, Connelly E, Soumyanth A, Buresh R, Barrett R, Zwickey H (2006). «The effect of Echinacea purpurea, Astragalus membranaceus and Glycyrrhiza glabra on CD69 expression and immune cell activation in humans». Phytotherapy Research 20: 687–695. PMID 16807880. - ↑ a b Taylor A, Watson C, Bradley J (2005). «Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy». Crit Rev Oncol Hematol 56 (1): 23-46. PMID 16039869.
- ↑ Barnes P (2006). «Corticosteroids: the drugs to beat». Eur J Pharmacol 533 (1-3): 2-14. PMID 16436275.
- ↑ Masri M (2003). «The mosaic of immunosuppressive drugs». Mol Immunol 39 (17-18): 1073-7. PMID 12835079.
- ↑ Welling GW, Wiejer WJ, van der Zee R, Welling-Werster S. (1985). «Prediction of sequential antigenic regions in proteins». J Mol Recognit 88 (2): 215-8. PMID 2411595.
- ↑ Sollner J, Mayer B. (2006). Machine learning approaches for prediction of linear B-cell epitopes on proteins. 19 (3). pp. 200-8. PMID 16598694.
- ↑ Saha S, Bhasin M, Raghava GP. (2005). «Bcipep: a database of B-cell epitopes.». BMC Bioinformatics 6 (1): 79. PMID 15921533.
- ↑ Flower DR, Doytchinova IA. (2002). «Immunoinformatics and the prediction of immunogenicity.». Appl Bioinformatics 1 (4): 167-76. PMID 15130835.
- ↑ a b Finlay B, McFadden G (2006). «Anti-immunology: evasion of the host immune system by bacterial and viral pathogens». Cell 124 (4): 767-82. PMID 16497587.
- ↑ Cianciotto NP. (2005). «Type II secretion: a protein secretion system for all seasons». Trends Microbiol. 13 (12): 581-8. PMID 16216510.
- ↑ Winstanley C, Hart CA (2001). «Type III secretion systems and pathogenicity islands». J Med Microbiol. 50 (2): 116-26. PMID 11211218.
- ↑ Finlay B, Falkow S (1997). «Common themes in microbial pathogenicity revisited[[Categoría:Wikipedia:Artículos con texto en inglés]]». Microbiol Mol Biol Rev 61 (2): 136-69. PMID 9184008. Wikienlace dentro del título de la URL (ayuda)
- ↑ Kobayashi H (2005). «Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections». Treat Respir Med 4 (4): 241-53. PMID 16086598.
- ↑ Housden N, Harrison S, Roberts S, Beckingham J, Graille M, Stura E, Gore M (2003). «Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus[[Categoría:Wikipedia:Artículos con texto en inglés]]». Biochem Soc Trans 31 (Pt 3): 716-8. PMID 12773190. Wikienlace dentro del título de la URL (ayuda)
- ↑ Burton, Dennis R.; Robyn L. Stanfield and Ian A. Wilson (2005). «Antibody vs. HIV in a clash of evolutionary titans». Proc Natl Acad Sci U S A. 102 (42): 14943-8. PMID 16219699.
- ↑ Cantin R, Methot S, Tremblay MJ. (2005). «Plunder and stowaways: incorporation of cellular proteins by enveloped viruses». J Virol. 79 (11): 6577-87. PMID 15890896.
- ↑ Retief F, Cilliers L (1998). «The epidemic of Athens, 430-426 BC». S Afr Med J 88 (1): 50-3. PMID 9539938.
- ↑ Plotkin S (2005). «Vaccines: past, present and future». Nat Med 11 (4 Suppl): S5-11. PMID 15812490.
- ↑ El Premio Nobel de Medicina de 1905 Nobelprize.org Visitado 8 de enero de 2007 (en inglés).
- ↑ Mayor Walter Reed, Cuerpo médico del ejército de Estados Unidos Walter Reed Army Medical Center. Visitado el 8 de enero de 2007.
- ↑ Metchnikoff, Elie; Translated by F.G. Binnie. (1905). Immunity in Infective Diseases[[Categoría:Wikipedia:Artículos con texto en inglés]] (Versión in extenso: Google Books). Cambridge University Press. ISBN 68025143. Wikienlace dentro del título de la URL (ayuda)
- ↑ El Premio Nobel de Medicina de 1908 Nobelprize.org Visitado el 8 de enero de 2007
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Inmunología.
Wikimedia Commons alberga una galería multimedia sobre Inmunología.
