Volatilidad (química)
La volatilidad desde el punto de vista químico, físico y de la termodinámica es una medida de la tendencia de una sustancia a pasar a la fase vapor. Se ha definido también como una medida de la facilidad con que una sustancia se evapora. A una temperatura dada, las sustancias con mayor presión de vapor se evaporan más fácilmente que las sustancias con una menor presión de vapor.
Un ejemplo de ello es el alcohol, a temperatura ambiente es prácticamente volátil, ya que comienza a evaporarse en forma espontánea, debido a que su temperatura de evaporación es muy baja. [1][2][3][4]
Aunque por lo general se aplica a líquidos, la volatilidad se puede aplicar a materiales sólidos como el hielo seco (sólido de dióxido de carbono y el cloruro de amonio), que pueden cambiar directamente de sólido a vapor sin pasar por el estado líquido. Este proceso se denomina sublimación.
Relación entre las presiones de vapor y los puntos normales de ebullición de los líquidos
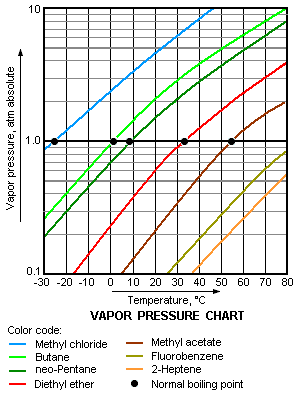
La presión de vapor es la presión que ejercen las moléculas del líquido que han escapado a la fase vapor en un recipiente cerrado donde se ha alcanzado el equilibrio. Muy a menudo el término se utiliza para describir la tendencia de un líquido a vaporizarse.
Se trata de una medida de la tendencia de las moléculas y átomos para escapar de un líquido o un sólido. La temperatura de ebullición de un líquido a presión atmosférica corresponde a la temperatura a la que su presión de vapor iguala a la presión atmosférica circundante, y a menudo se denomina temperatura de ebullición normal.
Cuanto mayor sea la presión de vapor de un líquido a una temperatura determinada, mayor es la volatilidad y menor es la temperatura de ebullición normal del líquido.
El gráfico de presión de vapor a la derecha tiene los gráficos de las presiones de vapor frente a la temperatura de una variedad de líquidos.[5] Como puede verse en el gráfico, los líquidos con la presión de vapor más elevada tienen los puntos de ebullición normales más bajos.
Por ejemplo, a cualquier temperatura dada, el propano tiene la mayor presión de vapor de los líquidos de la tabla. También tiene el menor temperatura de ebullición normal (-42,1°C), que es donde la curva de presión de vapor del propano (línea lila) cruza la línea de presión horizontal de una atmósfera de presión de vapor absoluta.
Véase también
- Relación de Clausius-Clapeyron
- Destilación
- Destilación fraccionada
- Presión parcial
- Ley de Raoult
- Presión de vapor
- Compuestos orgánicos volátiles
Referencias
- ↑ Gases and Vapor (University of Kentucky website)
- ↑ Definition of Terms (University of Victoria website)
- ↑ James G. Speight (2006). The Chemistry and Technology of Petroleum (4th Edition edición). CRC Press. ISBN 0-8493-9067-2.
- ↑ Kister, Henry Z. (1992). Distillation Design (1st Edition edición). McGraw-hill. ISBN 0-07-034909-6.
- ↑ Perry, RH y Green, DW (Editores) (1997). [Chemical Engineers '[Perry's Handbook]] (7 ª Edición edición). McGraw-Hill. ISBN 0-07 -049841-5.
Enlaces externos
- Esta obra contiene una traducción derivada de «Volatility (chemistry)» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Volatility from ilpi.com
- Definition of volatile from Wiktionary
