Triptófano hidroxilasa
| triptófano 5-monooxigenasa | ||||
|---|---|---|---|---|
 con Biopterina y Fe3+ unidos | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.4 | |||
| Número CAS | 9037-21-2 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Triptófano hidroxilasa 1 (Triptófano 5-monooxigenasa) | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB |
Lista de códigos PDB 1MLW
| |||
| Identificadores | ||||
| Símbolos | TPH1 (HGNC: 12008) TPRH, TPH | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.4 | |||
| Locus | Cr. 11 p15.3-p14 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Triptófano hidroxilasa 2 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | TPH2 (HGNC: 20692) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.4 | |||
| Locus | Cr. 12 q15 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
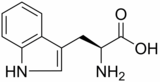
La Triptófano hidroxilasa (TPH) es una enzima (EC 1.14.16.4) implicada en la síntesis del neurotransmisor serotonina.
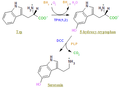
Reacción catalizada
La TPH cataliza la siguiente reacción:
L-triptófano + tetrahidrobiopterina + O2 5-Hidroxitriptófano + 4a-hidroxitetrahidrobiopterina
Es responsable de la adición de un grupo hidroxilo a la posición 5 del anillo indólico para formar 5-Hidroxitriptófano (5-HTP), que es la primera etapa paso limitante de la síntesis de serotonina. También es la primera enzima de la ruta de síntesis de melatonina.
Estructura y características enzimáticas
La TPH, la tirosina hidroxilasa (TH) y la fenilalanina hidroxilasa (PAH) son miembros de la familia de hidroxilasas de aminoácidos aromáticos, que catalizan pasos clave en rutas metabólicas importantes.[1] Estas enzimas utilizan tetrahidrobiopterina como coenzima y hierro (II) no unido a un grupo hemo como cofactor.[2] La actividad enzimática de la TPH puede regularse mediante varios mecanismos, como la fosforilación por proteína quinasas, Proteína quinasa A, por ejemplo.
Isoformas
En humanos, así como en la mayoría de los vertebrados hay más de un gen que codifican para varias isoformas de la enzima TPH. En humanos se han descrito dos:TPH1 localizado en el cromosoma 11 cuyo gen consiste en 10 exones que da lugar a una proteína final con 444 aminoácidos, y TPH2 en el cromosomas 12 con 11 exones y una longitud final de 490 aminoácidos. Ambas conservan una identidad del 71% en su secuencia.[3]
- TPH1 es expresa en la mayoría de los tejidos periféricos productores de serotonina: piel, intestino, glándula pineal pero también aparece en el sistema nervioso central.
- TPH2 se expresa exclusivamente en las neuronas y es la isoforma principal del sistema nervioso central.
Importancia clínica
En humanos la estimulación de la producción de serotonina o la administración de triptófano tienen efectos antidepresivos[cita requerida] y la inhibición de la TPH (por ejemplo, por administración de p-Clorofenilalanina) puede desencadenar episodios depresivos.[4]
Imágenes adicionales
-
Síntesis de serotonina a partir de tryptófano
-
Vía metabólica desde el triptófano a seronina
Referencias
- ↑ McKinney J, Teigen K, Frøystein NA, Salaün C, Knappskog PM, Haavik J, Martínez A (December de 2001). «Conformation of the substrate and pterin cofactor bound to human tryptophan hydroxylase. Important role of Phe313 in substrate specificity». Biochemistry 40 (51): 15591-601. PMID 11747434. doi:10.1021/bi015722x.
- ↑ Haavik, J., Toska, K., Tyrosine Hydroxylase and Parkinson’s Disease. Molecular Neurobiology, 1998. 16(3) :p.285-309.
- ↑ Walther DJ, Bader M (November de 2003). «A unique central tryptophan hydroxylase isoform». Biochem. Pharmacol. 66 (9): 1673-80. PMID 14563478. doi:10.1016/S0006-2952(03)00556-2.
- ↑ Wang L, Erlandsen H, Haavik J, Knappskog PM, Stevens RC (October de 2002). «Three-dimensional structure of human tryptophan hydroxylase and its implications for the biosynthesis of the neurotransmitters serotonin and melatonin». Biochemistry 41 (42): 12569-74. PMID 12379098. doi:10.1021/bi026561f.
Léase también
- Friedman PA, Kappelman AH, Kaufman S (1972). «Partial purification and characterization of tryptophan hydroxylase from rabbit hindbrain». J. Biol. Chem. 247 (13): 4165-73. PMID 4402511.
- Hamon M, Bourgoin S, Artaud F, Glowinski J (1979). «The role of intraneuronal 5-HT and of tryptophan hydroxylase activation in the control of 5-HT synthesis in rat brain slices incubated in K+-enriched medium». J. Neurochem. 33 (5): 1031-42. PMID 315449. doi:10.1111/j.1471-4159.1979.tb05239.x.
- Ichiyama A, Nakamura S, Nishizuka Y, Hayaishi O (1970). «Enzymic studies on the biosynthesis of serotonin in mammalian brain». J. Biol. Chem. 245 (7): 1699-709. PMID 5309585.
- Jequier E, Robinson DS, Lovenberg W, Sjoerdsma A (1969). «Further studies on tryptophan hydroxylase in rat brainstem and beef pineal». Biochem. Pharmacol. 18 (5): 1071-81. PMID 5789774. doi:10.1016/0006-2952(69)90111-7.
- Wang L, Erlandsen H, Haavik J, Knappskog PM, Stevens RC (2002). «Three-dimensional structure of human tryptophan hydroxylase and its implications for the biosynthesis of the neurotransmitters serotonin and melatonin». Biochemistry. 41 (42): 12569-74. PMID 12379098. doi:10.1021/bi026561f.
- Windahl MS, Petersen CR, Christensen, HEM, Harris P (2008). «Crystal Structure of Tryptophan Hydroxylase with Bound Amino Acid Substrate». Biochemistry. 47 (46): 12087-94. PMID 18937498. doi:10.1021/bi8015263.
Enlaces externos
- MeSH: Tryptophan+Hydroxylase (en inglés)
- Véase también tryptophan hydroxylase in Proteopedia