Síndrome de Walker-Warburg
| Síndrome de Walker-Warburg | ||
|---|---|---|
 | ||
| Especialidad |
oftalmología neurología genética médica | |
| Sinónimos | ||
|
Síndrome de Warburg; Síndrome de Chemke; Síndrome HARD; Disgenesia cerebroocular; Síndrome de distrofia muscular-displasia cerebroocular. | ||
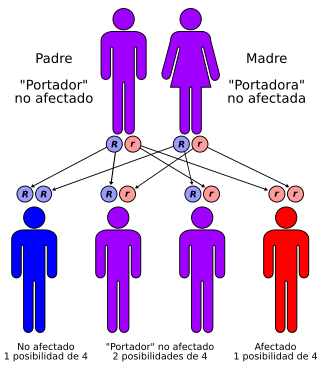
El síndrome de Walker-Warburg (WWS), también llamado síndrome de Warburg, síndrome de Chemke, síndrome HARD (hidrocefalia, agiria y displasia retiniana), síndrome de Pagon, disgenesia cerebroocular (DQO) o síndrome de distrofia muscular-displasia cerebroocular (COD-MD), es una forma rara de distrofia muscular congénita que sigue un patrón de herencia autosómica recesiva.[1] Además se asocia con anomalías en el cerebro, cerebelo y ojos. Es la forma más grave de distrofia muscular congénita, muriendo la mayoría de los afectados antes de cumplir los tres años.
Epidemiología[editar]
Su distribución es mundial. Estudios en el Nordeste de Italia han informado de una tasa de incidencia de 1,2 por cada 100.000 nacidos vivos,[2] aunque la prevalencia estimada es de 1'65 afectados por cada 100000 nacidos.[3]
Etiopatogenia[editar]
El complejo distrofina glicoproteína (DGC) es un conjunto de proteínas que abarcan el sarcolema del músculo esquelético.[4][5] Los defectos en el DGC parecen desempeñar un papel crítico en varias distrofias musculares debido a la interrupción de la organización de la membrana basal.[6] El distroglicano es un propéptido expresado en muchos tipos celulares que sufre una glicosilación post-traduccional para formar, entre otros, α-distroglicano, la glicoproteína unida a la distrofina. Las mutaciones que producen un descenso en la glicosilación son las implicadas en el WWS. Estas mutaciones afectan a los genes POMT1 (9q34),[7] POMT2[8] y el gen fukutina o FCMD (9q31).[9][10] Las mutaciones de los genes implicados detectados no se hallan en todos los pacientes, por lo que existen además otros genes aún no identificados.
Cuadro clínico[editar]
Los síntomas y signos ya pueden estar presentes en el momento del nacimiento y primera infancia. Este síndrome incluye hipotonía generalizada, debilidad muscular, retraso en el desarrollo con retraso mental y, en algunos niños, convulsiones. Existen una amplia variedad de anomalías del ojo que pueden estar presentes, entre las que se incluyen cataratas, microcórnea y microftalmia, defectos del cristalino, desprendimiento de retina, coloboma y displasia, hipoplasia o atrofia del nervio óptico y la mácula. El glaucoma y la bulftalmia (aumento considerable del volumen ocular) pueden estar presentes. Las anomalías del encéfalo que pueden detectarse en los afectados son lisencefalia tipo II, hidrocefalia, hipoplasia vermal o general cerebelosa y tronco del encéfalo plano con pequeñas pirámides. La sustancia blanca muestra hipomielinización. Se han descrito en afectados otras anomalías adicionales del cerebro tales como hipoplasia o agenesia del cuerpo calloso, encefalocele occipital y la malformación de Dandy Walker. Algunas anomalías asociadas que afectan a otros sistemas son pene pequeño, testículos no descendidos, y, en raras ocasiones, otros rasgos faciales dismórficos tales como implantación baja de las orejas o que estén prominentes y labio leporino y/o paladar hendido.
Diagnóstico[editar]
Aparte de los signos clínicos, los hallazgos laboratoriales suelen presentar elevados niveles de creatina quinasa e hipoglicosilación de α-distroglicano. El diagnóstico molecular prenatal es posible en las familias con mutaciones conocidas. La ecografía prenatal puede ser útil para el diagnóstico en las familias donde el defecto molecular es desconocido, detectando hidrocefalia a las 13 semanas de gestación[11] y encefalocele a las 18.[12]
Tratamiento[editar]
No hay tratamiento específico disponible. Las convulsiones deben tratarse con anticonvulsivos, se pueden realizar procedimientos quirúrgicos para tratar la hidrocefalia y el encefalocele y terapia física para prevenir el empeoramiento de las contracturas musculares. En algunos casos, la alimentación debe ser controlada y suplementaria por sonda nasogástrica o gástrica.
Epónimo[editar]
WWS lleva el nombre de Arthur Earl Walker y Mette Warburg.[13][14][15] Sus nombres alternativos incluyen el síndrome de Chemke y el síndrome de Pagon, llamada así por Juan M. Chemke y Roberta A. Pagon.[16]
Referencias[editar]
- ↑ Vajsar J, Schachter H (2006). «Walker-Warburg syndrome». Orphanet J Rare Dis 1: 29. PMC 1553431. PMID 16887026. doi:10.1186/1750-1172-1-29.
- ↑ Mostacciuolo ML, Miorin M, Martinello F, Angelini C, Perini P, Trevisan CP. Genetic epidemiology of congenital muscular dystrophy in a sample from the north-east Italy. Hum Genet. 1996;97:277–279. doi: 10.1007/BF02185752
- ↑ Prevalence of rare diseases: Bibliografic data, Informes periódicos de Orphanet, Serie de Enfermedades raras, Noviembre de 2010, Nº 1: Lista por orden alfabético
- ↑ Ervasti JM, Ohlendieck K, Kahl SD, Gaver MG, Campbell KP. Deficiency of a glycoprotein component of the dystrophin complex in dystrophic muscle. Nature. 1990;345:315–319. doi: 10.1038/345315a0.
- ↑ Ervasti JM, Campbell KP. Membrane organization of the dystrophin-glycoprotein complex. Cell. 1991;66:1121–1131. doi: 10.1016/0092-8674(91)90035-W
- ↑ Williamson RA, Henry MD, Daniels KJ, Hrstka RF, Lee JC, Sunada Y, Ibraghimov-Beskrovnaya O, Campbell KP. Dystroglycan is essential for early embryonic development: disruption of Reichert's membrane in Dag1-null mice. Hum Mol Genet. 1997;6:831–841. doi: 10.1093/hmg/6.6.831.
- ↑ Beltrán-Valero De Bernabé D, Currier S, Steinbrecher A, Celli J, Van Beusekom E, Van Der Zwaag B, Kayserili H, Merlini L, Chitayat D, Dobyns WB, Cormand B, Lehesjoki AE, Cruces J, Voit T, Walsh CA, Van Bokhoven H, Brunner HG. Mutations in the O-Mannosyltransferase Gene POMT1 Give Rise to the Severe Neuronal Migration Disorder Walker-Warburg Syndrome. Am J Hum Genet. 2002;71:1033–1043. doi: 10.1086/342975.
- ↑ van Reeuwijk J, Brunner HG, Van Bokhoven H. Glyc-O-genetics of Walker-Warburg syndrome. Clin Genet. 2005;67:281–289. doi: 10.1111/j.1399-0004.2004.00368.x.
- ↑ Beltrán-Valero de Bernabé D, van Bokhoven E, van Beusekom E, Van Den Akker W, Kant S, Dobyns WB, Cormand B, Currier S, Hamel B, Talim B, Topaloglu H, Brunner HG. A homozygous nonsense mutation in the Fukutin gene causes a Walker-Warburg syndrome phenotype. J Med Genet. 2003;40:845–848. doi: 10.1136/jmg.40.11.845.
- ↑ Toda T, Segawa M, Nomura Y, Nonaka I, Masuda K, Ishihara T, Sakai M, Tomita I, Origuchi Y, Suzuki M [corrected to Sakai M (noviembre de 1993). «Localization of a gene for Fukuyama type congenital muscular dystrophy to chromosome 9q31-33». Nat. Genet. 5 (3): 283-6. PMID 8275093. doi:10.1038/ng1193-283.
- ↑ Gasser B, Lindner V, Dreyfus M, Feidt X, Leissner P, Treisser A, Stoll C. Prenatal diagnosis of Walker-Warburg syndrome in three sibs. Am J Med Genet. 1998;76:107–110. doi: 10.1002/(SICI)1096-8628(19980305)76:2<107::AID-AJMG1>3.0.CO;2-Q.
- ↑ Farrell SA, Toi A, Leadman ML, Davidson RG, Caco C. Prenatal diagnosis of retinal detachment in Walker-Warburg syndrome. Am J Med Genet. 1987;28:619–624. doi: 10.1002/ajmg.1320280309.
- ↑ synd/1202 en Who Named It?
- ↑ Walker AE (1942). «Lissencephaly». Archives of Neurology and Psychiatry (Chicago) 48: 13-29.
- ↑ Warburg M (marzo de 1971). «The heterogeneity of microphthalmia in the mentally retarded». Birth Defects Orig. Artic. Ser. 7 (3): 136-54. PMID 4950916.
- ↑ http://www.whonamedit.com/synd.cfm/1202.html
Enlaces externos[editar]
