Reducción de Clemmensen
La reducción de Clemmensen es una reacción química en la cual se reduce una cetona o un aldehído a un alcano usando amalgama de zinc y mercurio (Hg), además de ácido clorhídrico para darle el medio ácido. Debe su nombre al químico danés Erik Christian Clemmensen.
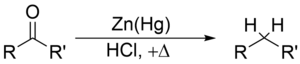
La reducción de Clemmensen es especialmente efectiva cuando se reducen aril-alquil cetonas. Con cetonas alifáticas o acíclicas, la reducción con zinc metálico es más efectiva.
El sustrato debe ser estable bajo la fuerte acidez del medio de reacción. Los sustratos sensibles a la acidez pueden reducirse mediante la reducción de Wolff-Kishner, donde se emplean condiciones muy básicas. Tras la reducción de Clemmensen, el carbono carbonílico pasa de una hibridación sp2 a una sp3. El oxígeno se pierde como agua.
Mecanismo[editar]
En realidad existen dos mecanismos que guían a que la alquil o aricetona o aldehído se conviertan en alcanos donde uno de ellos funciona con la formación de un carbanión y el otro con la división de electones formando radicales libres; de ahí vienen sus respectivos nombres: Mecanismo carbaniónico y mecanismo carbenoide.
- Mecanismo carbaniónico: Este mecanismo hace que un hidrógeno del ácido clorhídrico interactúe con la cetona protonando el oxígeno, haciendo que este pierda un par de electrones, pero luego entra zinc con un par electrónico donandoselos al oxígeno y a su vez este queda protonado. Entonces el cloro interactúa con el zinc compensando el par electrónico que le hace falta (el par de electrones que dona el cloro es el que inicialmente le "quitó" al hidrógeno), después otro hidrón interactúa con el -OH formado y se une formando agua, haciendo que el oxígeno salga del compuesto. Como consecuencia, la molécula queda con un carbocatión y automáticamente cloro se une con otro zinc que está en el medio y el zinc que está ligado a la molécula queda con su par libre de elctrones, quedando una carga negativa. Como hay dos cargas en el medio, el zinc dona sus electones al carbocatión formado convirtiéndolo en un carbanión. En este estado es posible que el carbanión interactúe con una átomo atractor de electrones que va a ser un hidrón. El hidrón entra y como el zinc está cargado positivamente, es expulsado cuando este interactúa con cloro del medio quedando otro par de electones en el carbono, es decir, otro carbanión. Pero finalmente otro hidrón entra al medio y forma el alcano.
- Mecanismo carbenoide: En este otro mecanismo, hay que tener en cuenta que sucede principalmente en una superficie metálica que es por supuesto, la amalgama. Todo empieza cuando uno de los dos enlaces de oxígeno se rompen y desplazan un electón al hidrógeno y el otro al carbono de la cetona. Estos electrones libres o , mejor, el carbeno formado interactúa con la superficie del metal, por lo que el zinc, en ambos lados donde están los electrones deciden compartir uno de los que posee, quedando los dos átomos de zinc con un electrón cada uno. A continuación, el enlace simple que unía a carbono y a oxígeno se fragmenta y al igual que al principio cada molécula se lleva consigo un solo electrón. Como el zinc tiene un electrón libre y el oxígeno por un lado y por el otro el carbono, estos se unen formando en ambos casos dobles enlaces.En el caso del oxígeno doblemente enlazado con zinc, este atrae dos hidrógenos del medio HCl y queda agua, mientras el zinc se une con el cloro formando ZnCl2. Por otro lado, la parte donde el carbono esta doblemente enlazado a zinc se protona con un hidrógeno quedando el zinc con carga positiva y pasa lo mismo que al final del otro mecanismo: el zinc es expulsado cuando este interactúa con cloro del medio quedando otro par de electones en el carbono y otro hidrón entra al medio y forma el alcano.
Referencias[editar]
- Vollhardt, Peter C.; Schore, Neil E. (1996). «Ataque electrófilo sobre derivados del benceno». En W.H. Freeman and Co., ed. Química Orgánica (2ª edición edición). p. 622.
