Reducción de Corey-Bakshi-Shibata
La reducción de Corey-Bakshi-Shibata (CBS), también conocida como la reducción de Corey-Itsuno, es una reacción química en la que se reduce enantioselectivamente una cetona aquiral para producir el alcohol quiral correspondiente. El reactivo oxazaborolidina, que media la reducción enantioselectiva de cetonas, se ha desarrollado previamente por el laboratorio de Itsuno y por lo tanto esta transformación puede ser llamada con más propiedad reducción con oxazaborolidina de Itsuno-Corey.[1]

En 1981, Itsuno y colaboradores reportaron por primera vez el empleo de complejos quirales de alcoxi-borano de aminas en la reducción de cetonas aquiral a los alcoholes quirales enantioselectively y en el alto rendimiento.[1]
Varios años más tarde, en 1987, Elias James Corey y sus colaboradores desarrollaron la reacción entre aminoalcoholes quirales y borano (BH3), generando productos de oxazaborolidina. Se mostró que dichos productos catalizaban rápidamente la reducción enantioselectiva de cetonas aquirales en la presencia de BH3•THF.[2][3]
La reducción de la CBS desde entonces ha sido utilizada por los químicos orgánicos como un método fiable para la reducción asimétrica de cetonas aquirales. En particular, se ha encontrado una amplia aplicación, no sólo en una gran cantidad de síntesis de productos naturales, sino que se ha utilizado en gran escala en la industria.[4][5] Varios análisis han sido publicados.[6]
Mecanismo[editar]
Corey y colaboradores originalmente propusieron el siguiente mecanismo para explicar la selectividad obtenida de la reducción catalítica.[2][3]
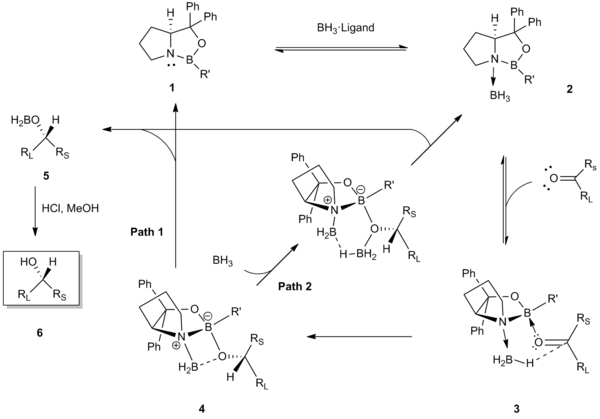
El primer paso del mecanismo consiste en la coordinación del borano al átomo de nitrógeno del catalizador oxazaborolidina 1. Esta coordinación sirve para activar el BH3 como donante de grupos hidruro y aumentar la acidez de Lewis del boro endocíclico del catalizador.[5] Las estructuras cristalinas de rayos X y análisis espectroscópico de 11B RMN del complejo catalizador-borano coordinado 2 han sustentado la propuesta de este paso inicial.[5][7] Posteriormente, el boro endocíclico del catalizador se coordina a la cetona por el par de electrones no enlazados estéricamente más accesible (es decir, el par no enlazado cerca del sustituyente menos impedido, R). Esta unión preferencial en 3 actúa para minimizar las interacciones estéricas entre la cetona (con el sustituyente RL orientado en sentido opuesto) y el grupo R del catalizador. Se alinea el carbonilo y el borano coordinados para una transferencia favorable de hidruro por la cara selectiva a través de un estado de transición de seis miembros (4).[8][9] La transferencia de hidruro produce el enolato quiral de boro correspondiente 5, el cual por acción de un a´cido produce el alcohol 6. El último paso para regenerar el catalizador, puede realizarse por dos vías diferentes (Ruta 1 o 2).[10][11][12]
La fuerza motriz predominante de esta cara selectiva en la transferencia de hidruro intramolecular es la activación simultánea del reactivo borano por coordinación con el nitrógeno básico (Ácidos y bases de Lewis) y el aumento de la acidez de Lewis del boro endocíclico del catalizador para la coordinación de la cetona.[5]
Aplicaciones y limitaciones[editar]
Estéreo y quimioselectividad[editar]
La reducción con CBS ha demostrado ser un método eficaz y poderoso para reducir una amplia gama de diferentes tipos de cetonas, tanto en forma estereoselectiva como quimoselectiva. Los sustratos incluyen una gran variedad de cetonas aril-alifáticas, di-alifáticas, di-arílicas, sistemas α,β insaturados (Alquenos y alquinos), así como las cetonas que contienen heteroátomos.[5][13] La combinación de diferentes derivados del catalizador CBS y agentes de reducción de borano se han empleado para optimizar la enantioselectividad.

Vale la pena destacar varios casos interesantes en esta selección de substratos. En primer lugar, en el caso del sistema diarílico 9, se logra una estereoselectividad relativamente alta a pesar de la naturaleza de los sustituyentes isostéricos de la cetona, lo que sugiere que los efectos electrónicos, además de los histéricos, pueden desempeñar un papel en la estereoselectividad de la reducción de la CBS.[5] Las diferencias en la sustitución de los restos alquino en las inonas 11 y 12 resultan en un cambio de selectividad para el alquino, en donde funcionan como el sustituto más estéricamente voluminoso en lugar de la más pequeña. Para sistemas α, β insaturados sistemas (10-12), la reducción eficiente de la cetona se produce a pesar de las reacciones secundarias posibles de hidroboración en el doble enlace C-C. También se ha demostrado que la reducción de la CBS tolera la presencia de heteroátomos como en el caso de la cetona 13, que es capaz de coordinarse con el borano.
Consideraciones experimentales y limitaciones[editar]
Se ha demostrado que la presencia de agua en la mezcla de reacción tiene un efecto significativo en los excesos enantioméricos, por lo que la reducción de la CBS debe llevarse a cabo bajo condiciones anhidras.[14] La temperatura también juega un papel crítico en la estereoselectividad observada. En general, a temperaturas más bajas, el exceso enantiomérico (ee) se obtiene; sin embargo, cuando la temperatura se incrementa, los valores de ee alcanzan un valor máximo que depende de la estructura del catalizador y agente reductor de borano utilizado.[15] El uso del reactivo catecolborano, del cual ha sido demostrado que participa en la reducción de la CBS, se llevó a cabo a temperaturas tan bajas como -126 °C con marcada enantioseletividad, lo que mostró ofrecer una solución potencial a la mejora de los valores disminuidos de ee obtenidos a temperaturas más bajas.[16][17]
Las cuestiones de enantioselectividad asociadas con el uso de BH3 como agente reductor del CBS han sido reportadas. Soluciones comerciales disponibles de BH3•THF han sido evaluadas por Nettles et al.. Se demostró que estas soluciones contienen pequeñas cantidades de especies borohidruro, que participan en las reducciones no selectivas que desembocó a una disminución de la enantioselectividad.[18] Aunque la vía de la reducción catalizada por el borohidruro es mucho más lenta que la reducción catalizada por el CBS, la reacción secundaria sigue presentando un desafío potencial para optimizar la estereoselectividad de la reacción.
A pesar de que el catalizador CBS desarrollado por Corey han llegado a ser muy empleados en la reacción de reducción de la CBS, otros derivados del catalizador se han desarrollado y utilizado con éxito. El grupo R' del catalizador CBS juega un papel importante en la enantioselectividad de la reducción, y como se muestra anteriormente, algunas variaciones del grupo R del catalizador CBS han sido empleadas para optimizar la selectividad.[5][13]
Durante el último par de décadas, la reducción CBS ha ganado utilidad sintética significativa en la síntesis de un número importante de productos naturales, incluyendo lactonas, terpenos, alcaloides, esteroides, y Biotinas.[5][6][19] La reducción enantionselectiva también se ha empleado en gran escala en la industria. Jones et al. utilizaron la reducción de la CBS en la síntesis total del MK-0417, un inhibidor de la anhidrasa carbónica soluble en agua que se ha utilizado terapéuticamente para reducir la presión intraocular.[14] La reducción asimétrica de un intermediario clave, una sulfona bicíclica, se llevó a cabo con el catalizador de oxazaborolidina CBS, que contiene metilo como el grupo R'.

Véase también[editar]
Referencias[editar]
- ↑ a b Hirao, A.; Itsuno, S.; Nakahama, S.; Yamazaki, N. (1981), Journal of the Chemical Society, Chemical Communications 7: 315, doi:10.1039/C39810000315.
- ↑ a b Corey, E. J.; Bakshi, R. K.; Shibata, S. (1987), Journal of the American Chemical Society 109: 5551, doi:10.1021/ja00252a056.
- ↑ a b Corey, E. J.; Bakshi, R. K.; Shibata, S.; Chen, C. P.; Singh, V. K. (1987), Journal of the American Chemical Society 109: 7925, doi:10.1021/ja00259a075.
- ↑ Deloux, L.; Srebnik, M. (1993), Chemical Reviews 93: 763, doi:10.1021/cr00018a007.
- ↑ a b c d e f g h Corey, E. J.; Helal, C. J. (1998), Angewandte Chemie International Edition 37: 1986, doi:10.1002/(sici)1521-3773(19980817)37:15<1986::aid-anie1986>3.0.co;2-z.
- ↑ a b Cho, B. T. (2006), Tetrahedron 62: 7621, doi:10.1016/j.tet.2006.05.036.
- ↑ Corey, E. J.; Azimioara, M.; Sarshar, S. (1992), Tetrahedron Letters 33: 3429, doi:10.1016/s0040-4039(00)92654-6.
- ↑ Evans, D. (1988), Science 240: 420, doi:10.1126/science.3358127.
- ↑ Jones, D. K.; Liotta, D. C.; Shinkai, I.; Mathre, D. J. (1993), The Journal of Organic Chemistry 58: 799, doi:10.1021/jo00056a001.
- ↑ Corey, E. J. (1990), Journal of the American Chemical Society 62: 1209, doi:10.1351/pac199062071209.
- ↑ Nevalainen, V. (1994), Tetrahedron: Asymmetry 5: 289, doi:10.1016/s0957-4166(00)86186-8.
- ↑ Quallich, G. J.; Blake, J. F.; Woodall, T. M. (1994), Journal of the American Chemical Society 116: 8516, doi:10.1021/ja00098a012.
- ↑ a b Quallich, G. J.; Woodall, T. M. (1993), Tetrahedron Letters 34: 785, doi:10.1016/0040-4039(93)89012-f.
- ↑ a b Jones, T. K.; Mohan, J. J.; Xavier, L. C.; Blacklock, T. J.; Mathre, D. J.; Sohar, P.; Jones, E. T. T.; Reamer, R. A.; Roberts, F. E.; Grabowski, E. J. J. (1991), The Journal of Organic Chemistry 56: 763, doi:10.1021/jo00002a050.
- ↑ Bulliard, Michael (1999). «Chapter 11.1: Asymmtric Reduction of Prochiral Ketones Catalyzed by Oxazaborolidines». En Ager, David, ed. Handbook of Chiral Chemicals. Marcel Decker. pp. 211–225. ISBN 0824710584.
- ↑ Corey, E. J.; Link, J. O. (1989), Tetrahedron Letters 30: 6275, doi:10.1016/s0040-4039(01)93871-7.
- ↑ Corey, E. J.; Bakshi, R. K. (1990), Tetrahedron Letters 31: 611, doi:10.1016/s0040-4039(00)94581-7.
- ↑ Nettles, S. M.; Matos, K.; Burkhardt, E. R.; Rouda, D. R.; Corella, J. A. (2002), The Journal of Organic Chemistry 67: 2970, doi:10.1021/jo016257c.
- ↑ Stemmler, R. T. (2007), Synlett 6: 997, doi:10.1055/s-2007-973876.
