Reconfiguración de Favorskii
La transposición de Favorskii (que no debe confundirse con la reacción de Favorskii), llamada así por el químico ruso Alekséi Favorski, es principalmente una transposición de ciclopropanonas y α-halo cetonas que conduce a derivados de ácidos carboxílicos. En el caso de α-halo cetonas cíclicas, la transposición de Favorskii constituye una contracción del anillo. Esta transposición se lleva a cabo en presencia de una base, a veces hidróxido, para producir un ácido carboxílico, pero la mayor parte del tiempo, o bien un alcóxido o una amina para dar un éster o una amida respectivamente. Las α, α'- dihalocetonas eliminan HX en las condiciones de reacción para dar compuestos carbonílicos α,β insaturados.[1][2][3][4][5][6][7]
Historia[editar]
En sus investigaciones sobre la química de las cetonas α-halogenadas Favorski observó que, tratando algunas dihalocetonas alifáticas del tipo RCH2CX2COCH2 R' con hidróxido de potasio diluido se formaban ácidos carboxílicos α,β-insaturados (véase más adelante).[8]
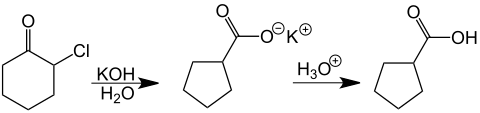
Como un ejemplo de la reacción de una monohalogenocetona, examinó α-clorociclohexanona, obteniendo después de la acidificación de la solución el carboxilato del ácido ciclopentanocarboxílico. Este tiempo de reacción fue especialmente notable porque fue desarrollado a partir del anillo de carbono de seis miembros a un anillo de cinco carbonos.[9][10]
Mecanismo de la reacción[editar]
El mecanismo de reacción se cree que implica la formación de un enolato en el lado de la cetona lejos del átomo del halógeno. Este enolato se cicla a una ciclopropanona como intermedio, que es atacado por el hidróxido nucleófilo.

El uso de aniones alcóxido tales como metóxido de sodio, en lugar de hidróxido de sodio, conduce al éster, con un ciclo más pequeño.
|
| animación |
La degradación de Wallach[editar]
En el método relacionado de la degradación de Wallach (Otto Wallach, 1918) existen dos átomos de halógeno a ambos lados de la cetona, resultando en una cetona nueva contraída, después de la oxidación y descarboxilación.[11][12]
Transposición foto-Favorskii[editar]
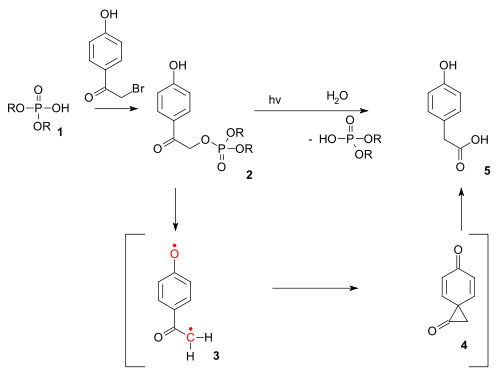
El tipo de reacción también existe como reacción fotoquímica. Se ha utilizado en el desbloqueo fotoquímica de ciertos fosfatos (por ejemplo los ATP) protegido por los llamados grupos p-hydroxyphenacyl.[13] El producto de desprotección a través de un triplete birradical (3) y un diona espiro intermedio (4), aunque este último hasta ahora ha eludido la detección.[14]
Utilidad[editar]
- En síntesis orgánica la transposición de Favorskii se utiliza cada vez que la alternativa de la síntesis de los ácidos carboxílicos o ésteres es más complicada que la de las α-halocetonas.
- Con la transposición de Favorskii, por regla general, compuestos cíclicos con un anillo de n-miembros pueden ser convertidos en otro de (n-1)-miembros.
- Causó una gran sensación la síntesis del hidrocarburo cubano por Eaton, en el que una transposición de Favorskii es un paso clave.

Referencias[editar]
- ↑ Favorskii, A. E. J. Russ. Phys. Chem. Soc. 1894, 26, 590.
- ↑ Favorskii, A. E. J. Russ. Phys. Chem. Soc. 1905, 37, 643.
- ↑ Favorskii, A. E. J. Prakt. Chem. 1913, 88, 658.
- ↑ Kende, A. S. Org. React. 1960, 11, 261-316. (Review)
- ↑ Organic Syntheses, Coll. Vol. 6, p.368 (1988); Vol. 56, p.107 (1977). (Article)
- ↑ Shioiri, T.; Kawai, N. J. Org. Chem. 1978, 43, 2936.
- ↑ Organic Syntheses, Coll. Vol. 7, p.135 (1990); Vol. 62, p.191 (1984). (Article)
- ↑ A. Faworski, Journal der Russischen Physikalisch-Chemischen Gesellschaft, 26, 559 (1894); Journal für praktische Chemie, 51,533 (1895).
- ↑ A. Faworski, W. Boshowski: Über isomere Umwandlungen der cyclischen α-Monochlorketone, Journal der Russischen Physikalisch-Chemischen Gesellschaft, 46, 1097-1102 (1914); Chemisches Zentralblatt 1915 I, 984:
- ↑ Organic Syntheses, Coll. Vol. 4, p.594 (1963); Vol. 39, p.37 (1959). (Article)
- ↑ Zur Kenntnis der Terpene und der ätherischen Öle. Über das Verhalten zweifach gebromter hexacyclischer Ketone in Abhängigkeit von der Stellung der Bromatome Justus Liebig's Annalen der Chemie Volume 414, Issue 3 , Pages 271 - 296 O. Wallach 1918 doi 10.1002/jlac.19184140303
- ↑ Zur Kenntnis der Terpene und der ätherischen Öle (p 296-366) O. Wallach Justus Liebig's Annalen der ChemieVolume 414, Issue 3 , Pages 296 - 366 1918 doi 10.1002/jlac.19184140304
- ↑ New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes Chan-Ho Park and Richard S. Givens J. Am. Chem. Soc.; 1997; 119(10) pp 2453 - 2463; (Article) doi 10.1021/ja9635589
- ↑ The Photo-Favorskii Reaction of p-Hydroxyphenacyl Compounds Is Initiated by Water-Assisted, Adiabatic Extrusion of a Triplet Biradical Richard S. Givens, Dominik Heger, Bruno Hellrung, Yavor Kamdzhilov, Marek Mac, Peter G. Conrad, II, Elizabeth Cope, Jong I. Lee, Julio F. Mata-Segreda, Richard L. Schowen and Jakob Wirz J. AM. CHEM. SOC. 2008, 130, 3307-3309 doi 10.1021/ja7109579
Bibliografía[editar]
- Robert Jacquier, Rearrangement des cétones α-halogénées en acides sous l’influence des reactifs alcalins (Reaction de Faworsky), Bull. Soc. Chim. France 1950, D 35-45.
- Andrew Kende, The Favorskii Rearrangement, Org. React. 11, 261-316 (1960).
- J. M. Conia, J. R. Salaün, Cyclobutane Ring Contractions Not Involving Carbonium Ions, Acc. Chem. Res. 1972, 33-40.DOI:10.1021/ar50049a005.
- J. Bülle, A. Hüttermann, Das Basiswissen der Organischen Chemie, Wiley-VCH, 2000.