Neurociencia molecular
La Neurociencia molecular es una rama de la neurociencia que hace uso de los conceptos de la biología molecular aplicados al sistema nervioso de los animales. El campo de aplicación de esta materia pertenece principalmente a un enfoque reduccionista de la neurociencia, considerando temas como neuroanatomía molecular, mecanismos de señalización molecular en el sistema nervioso, los efectos de la genética en el desarrollo neuronal, y las bases moleculares de la neuroplasticidad y de las enfermedades neurodegenerativas.[1] Como en la biología molecular, la neurociencia molecular es un campo relativamente nuevo y es considerado como dinámico.
Localización de neurotransmisores[editar]
En biología molecular, la comunicación entre neuronas normalmente ocurre por medio de transiciones químicas a través de los espacios entre las células llamadas sinapsis. Los químicos transmitidos, conocidos como neurotransmisores, regulan una fracción significativa de las funciones vitales del cuerpo.[2] Es posible localizar anatómicamente los neurotransmisores por medio de técnicas de marcaje. Es posible de identificar químicamente ciertos neurotransmisores como las catecolaminas por medio de fijación neural de secciones de tejido con formaldehído. Esto puede dar lugar a que el formaldehído induzca fluorescencia al ser expuesto a luz ultravioleta (UV). La dopamina, una catecolamina, fue identificada en el nematodo C. elegans por medio de esta técnica.[3] La inmunocitoquímica, que involucra la generación de anticuerpos en contra de las entidades químicas o biológicas blanco. Un neurotransmisor blanco puede ser específicamente marcado por anticuerpos primarios y secundarios mascados con sondas radioactivas para identificar al neurotransmisor por autoradiografía. La presencia de neurotransmisores (aunque no sea necesariamente en su ubicación regular) puede ser observado por medio de inmunocitoquímica ligada a enzimas o por medio de un ensayo por inmunoabsorción ligado a enzimas en el que la unión del sustrato en los ensayos enzimáticos puede inducir [precipitado]]s, fluorocromos, o quimioluminiscencia. En el caso de que los neurotransmisores no puedan ser identificados, un método alternativo es localizarlos por medio de sus mecanismos de captación neuronales.[1]
Canales iónicos dependientes de voltaje[editar]

Las células excitables en los organismos vivos tienen canales iónicos dependientes de voltaje. Esto puede verse en todas las neuronas del sistema nervioso. Los primeros canales iónicos que pudieron ser caracterizados fueron los canales iónicos de sodio y potasio por A.L. Hodgkin and A.F. Huxley en 1950s al estudiar el axón gigante de un Loligo del género del calamar. Su investigación demostró la permeabilidad selectiva de las membranas celulares, dependiendo de las condiciones fisiológicas, y de los efectos eléctricos resultantes de estas permeabilidades para producir los potenciales de acción[4]
Canal iónico de sodio[editar]
Los canales de sodio fue el primer canal iónico dependiente de voltaje en ser aislado en 1984 de la anguila Electrophorus electricus por Shosaku Numa. La Tetrodotoxina del Tetraodontidae, un bloqueador del canal de sodio, fue usada para aislar la proteína del canal de sodio al unirla usando la técnica de la columna de cromatografía para una separación química. La secuencia de aminoácidos de la proteína fue analizada por medio de la degradación de Edman y después fue utilizada para construir una librería de cDNA la cual pudo ser usada para clonar la proteína del canal. La clonación del propio canal permite utilizarlo para varias aplicaciones como la identificación de estos canales en otros animales.[1] Se sabe que los canales de sodio trabajan en conjunto con los canales de potasio durante el desarrollo de un potencial de gradiente y de los potenciales de acción. Los canales de sodio permiten el flujo de iones de Na+ hacia dentro de la neurona, resultando en la despolarización del potencial de reposo de la neurona para llevar a un potencial de gradiente o un potencial de acción, dependiendo del grado de despolarización.[5]
Canal iónico de potasio[editar]
Los canales iónicos de potasio tienen una gran variedad de formas, están presentes en la mayoría de las células eukariotas, y normalmente tienden a estabilizar la membrana celular con el potencial de equilibrio de potasio. Como en el caso del canal de sodio, los potenciales de gradiente y los potenciales de acción, los canales de potasio también son dependientes de ellos. Mientras el flujo hacia dentro de la célula de los iones de Na+ inducen la despolarización celular, el flujo de los iones de K+ hacia afuera de la célula provoca la repolarización de la célula para contrarrestar el potencial de membrana. La activación de los canales iónicos de potasio por sí solos son dependientes de la despolarización resultante del flujo hacia dentro de los iones de Na+ durante el potencial de acción.[1] Como en el caso de los canales de sodio, los canales de potasio también tienen sus propias toxinas que los bloquean impidiendo la acción de la proteína. Un ejemplo de una toxina, es el caso del gran catión, tetraetilamonio (TEA), pero es notable que la toxina no tiene el mismo mecanismo de acción en todos los canales de potasio, dado la gran variedad de tipos de canales en las diferentes especies. La presencia de canales de potasio fue identificada por primera vez en una mutante de moscas Drosophila melanogaster que sacudió incontrolablemente a la anestesia debido a problemas en la repolarización celular que derivó en neuronas anormales y en la electrofisiología del músculo. Los canales de potasio fueron identificados por primera vez por medio de la manipulación genética molecular de las moscas en lugar de la realización de una purificación de la proteína ya que no se conocían, en el tiempo del descubrimiento, ligandos de alta afinidad a canales de potasio (como el TEA).[1][6]
Canal iónico de calcio[editar]
Los canales de calcio son importantes para ciertas cascadas de señalización celular así como en la liberación de neurotransmisores en los axones terminales. Una gran variedad de canales iónicos de calcio son encontrados en células excitables. Como en el caso de los canales de sodio, los canales de calcio fueron aislados y clonados por medio de técnicas de purificación cromatográfica. Es notable, como en el caso de la liberación de neurotransmisores, que los canales de calcio pueden interactuar con las proteínas intercelulares y juegan un papel muy importante en la señalización, especialmente en lugares como en el retículo endoplasmático de las células musculares.[1]
Receptores[editar]
Diferentes tipos de receptores pueden ser utilizados para la señalización y comunicación celular y pueden incluir receptores ionotrópicos y receptores metabotrópicos. Los tipos de receptores de superficie celular son diferenciados por su mecanismo y duración de acción con los receptores ionotrópicos asociados con la transmisión rápida de señales y con los receptores metabotrópicos asociados con la transmisión lenta de señales. Los receptores metabotrópicos cubren una amplia variedad de receptores de superficie celular con diferentes cascadas de señalización particulares.[1][5]
Receptores ionotrópicos[editar]
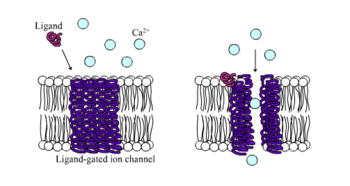
Los receptores ionotrópicos, también conocidos como canales iónicos dependientes de ligando, son rápidos receptores de acción que regulan la función neural y fisiológica por medio del flujo del canal iónico con la unión del ligando. Los receptores Nictoninc, GABA, y los receptores de glutamato son algunos de los receptores de superficie celular regulados por el flujo de canales iónicos dependientes de ligando. GABA es el principal neurotransmisor inhibidor en el cerebro y el glutamato es el principal neurotransmisor excitador del cerebro.[1]
Receptores GABA[editar]
Los receptores GABAA y GABAC son ionotrópicos, mientras que los receptores GABAB son metabotrópicos. Los receptores GABAA regulan las rápidas respuestas de inhibición en el sistema nervioso central (SNC) y son encontrados en las neuronas, células gliales y células de la médula adrenal. Es responsable de inducir el flujo hacia dentro de las células del ion Cl-, de ese modo reduce la probabilidad de que ocurra la despolarización de la membrana al ocurrir un potencial de gradiente o un potencial de acción. Los receptores GABA pueden también interaccionar con los ligandos no endógenos para influenciar en su actividad. Por ejemplo, el compuesto diazepam (comercializado como Valium) es un agonista alostérico que incrementa la afinidad del receptor GABA. El incremento de los efectos fisiológicos inhibitorios resultantes del incremento de la unión de GABA a su receptor, hace del diazepam un útil tranquilizante o antiepiléptico. Por el otro lado, los receptores GABA pueden ser el blanco al decrecer el flujo de Cl- hacia dentro de la célula con el efecto de convulsivos como la picrotoxina. El mecanismo de acción antagónico para este compuesto no es directamente sobre el receptor GABA, pero hay otros compuestos que son capaces de una inactivación alostérica, entre ellos está el T-butilbicicloforotionato (TBPS) y el pentilenetetrazol (PZT).
Comparado con GABAA, los receptores GABAC tienen una mayor afinidad a GABA, son de mayor duración en actividad, y su respuesta es generada por bajas concentraciones en GABA.[1]
Receptores de glutamato[editar]
Los receptores de glutamato ionotrópicos pueden incluir a los receptores NMDA, AMPA, y al receptor de kainato. Estos receptores llevan el nombre de los agonistas que facilitan la actividad del glutamato. Los receptores de NMDA son notables por sus mecanismos excitatorios para afectar la plasticidad neuronal en el aprendizaje y memoria, así como en neuropatologías como un accidente cerebrovascular y epilepsia. Los receptores NMDA tienen múltiples sitios de unión como los receptores ionotrópicos GABA y pueden ser influenciados por co-agonistas como el neurotransmisor glicina o fenciclidina (PCP por sus siglas en inglés). Los receptores NDMA llevan una corriente por iones Ca2+ y pueden ser bloqueados por iones Mg2+ extracelulares dependiendo del voltaje y del potencial de membrana. Este flujo de iones Ca2+ hacia dentro de la célula es incrementado por el potencial excitatorio postsináptico (PEPS] producido por los receptores NMDA, activando las cascadas de señalización basadas en Ca2+ (como la liberación de neurotransmisores). AMPA genera flujos excitatorios postsinápticos más cortos y más largos que cualquier otro receptor ionotrópico de glutamato.[5]
Receptores nicotínico ACh[editar]
El receptor nicotínico une el neurotransmisor acetilcolina para producir un flujo de canal catiónico no selectivo que genera respuestas excitatorias postsinápticas. La actividad del receptor, que puede ser influenciado por el consumo de nicotina, produce sentimientos de euforia, relajación, una inevitable adicción en altos niveles.[5]
Receptores metabotrópicos[editar]

Los receptores metabotrópicos son receptores de respuesta lenta en las células postsinápticas. Normalmente estas respuestas lentas son caracterizadas por cambios bioquímicos intracelulares más elaborados. Las respuestas de la captación de los neurotransmisores por receptores metatrópicos pueden resultar en la activación de enzimas intracelulares y cascadas involucrando a segundos mensajeros, como en el caso del receptor acoplado a proteínas G. Entre algunos receptores metatrópicos se pueden incluir ciertos receptores de glutamato, receptores muscarínicos ACh, receptores GABAB, y receptores de tirosina quinasa.
Receptores acoplados a proteína G[editar]
La cascada de señalización del receptor acoplado a proteínas G puede amplificar significativamente la señal de un neurotransmisor en particular para producir cientos de miles de segundos mensajeros en la célula. El mecanismo de acción con el que el receptor acoplado a proteínas G provoca la cascada de señalización es el siguiente:
- El neurotransmisor se une al receptor
- El receptor sufre un cambio conformacional para permitir la unión del complejo de proteína G
- El GTP es cambiado por GTP al unirse el complejo de proteína G con el receptor
- La subunidad α del complejo de proteína G está unido al GTP y se separa para unirse con la proteína blanco como la adenil ciclasa
- La unión a la proteína blanco incrementa o disminuye la velocidad de la producción de segundos mensajeros (como AMP cíclico)
- La GTPasa hidroliza la subunidad α para que este unida a GDP y la subunidad regrese al complejo inactivo del complejo de proteína G
Liberación de neurotransmisores[editar]

Los neurotransmisores son liberados en paquetes discretos conocidos como quanta desde el axón terminal de una neurona hacia las dendritas de la otra a través de la sinapsis. Estas quantas han sido identificadas por microscopía electrónica como vesículas sinápticas. Hay dos tipos de vesículas las vesículas sinápticas pequeñas (SSVs por sus siglas en inglés), las cuales miden alrededor de 40 a 60 nanómetros de diámetro, y las vesículas grandes de núcleo denso (LDCVs por sus siglas en inglés), estas miden alrededor de 120 a 200 nm de diámetro.[1] El precursor es derivado de endosomas y de neurotransmisores "guardianes" como la acetilcolina, glutamato, GABA, y glicina. Este último es derivado del aparato de golgi y de neurotransmisores grandes como las catecolaminas y otros neuropéptidos.[7] Los neurotransmisores son liberados de un axón terminal y se unen a las dendritas postsinápticas en el siguiente orden:[5]
- Movilización/reclutamiento de vesículas sinápticas por el citoesqueleto
- Unir la vesícula a la membrana presináptica
- Usar a ATP como cebador para la vesícula (paso relativamente lento)
- Fusión de la vesícula cebada con la membrana presináptica y exocita al neurotransmisor
- Captación del neurotransmisor en los receptores de la célula post sináptica
- Iniciación o inhibición del potencial de acción en la célula postsináptica dependiendo si el neurotransmisor es excitador o inhibidor (si es excitador va a derivar en la despolarización de la membrana postsináptica)
Liberación de neurotransmisor dependiente de calcio[editar]
La liberación del neurotransmisor es dependiente se un recurso externo de iones de Ca2+ los cuales entran a los axones terminales vía canales de calcio dependientes de voltaje. La fusión vesicular con la membrana terminal y la liberación del neurotransmisor es causado por la generación de gradientes de Ca2+ inducidos por el surgimiento de un potencial de acción. Los iones Ca2+ provocan la movilización de nuevas vesículas sintetizadas en la célula para ir hacia esta fusión de membrana. Este mecanismo de acción fue descubierto en los axones gigantes de un calamar.[8] La disminución de iones Ca2+ provoca un efecto inhibitorio directo en la liberación de neurotransmisores.[1] Después de que ocurre la liberación del neurotransmisor, las membranas vesiculares son recicladas hacia su origen de producción. Los canales iónicos de calcio pueden variar dependiendo de la ubicación de la incidencia. Por ejemplo, los canales en el axón terminal difieren de los canales típicos de calcio de otra célula del cuerpo (puede ser neural o no). Incluso en el axón terminal, los canales iónicos de calcio pueden variar, como es el caso con los canales de calcio de tipo P localizados en la unión neuromuscular.[1]
Expresión genética neuronal[editar]
Diferencias por sexo[editar]
Las diferencias en la determinación por sexo son controladas por los cromosomas sexuales. La liberación de hormonas sexuales tiene un efecto significativo en los dimorfismos sexuales (diferenciación fenotípica de las características sexuales) del cerebro. Estudios recientes parecen sugerir que la regulación de estos dimorfismos tiene implicaciones para el entendimiento de las funciones cerebrales normales y anormales. Los dimorforfismos sexuales pueden estar significativamente influenciados por la expresión genética en el cerebro basada en el sexo la cual varía de una especie a otra.
Los modelos animales como los roedores, Drosophila melanogaster, y Caenorhabditis elegans, han sido usados para observar los orígenes y/o comparar las vías sexuales en el cerebro contra la producción de hormonas por las gónadas de un animal. Con los roedores, estudios de manipulación genética de los cromosomas sexuales resultaron en efectos completamente diferentes entre un sexo y otro. Por ejemplo, un knockout de un gen en particular solamente resultaba como en efectos como ansiedad en hombre. En los estudios con D. menlanogaster se encontró que gran parte de la expresión de las vías sexuales del cerebro ocurren inclusive después de que las gónadas son removidas, sugiriendo que las vías sexuales pueden ser independiente del control hormonal en algunos aspectos.[9]
Observar los genes sexuales parciales tienen un potencial para un significado clínico al observar la fisiología del cerebro y la relación potencial con los desórdenes neurológicos (ya sea directo o indirecto). Algunos ejemplos de enfermedades relacionadas con el desarrollo de la exclusión por sexo son enfermedad de Huntington, isquemia cerebral, y Enfermedad de Alzheimer.[9]
Epigenética del cerebro[editar]
Muchas funciones cerebrales pueden ser influenciadas a un nivel celular y molecular por las alteraciones y cambios en la expresión genética, sin alterar la secuencia de DNA en el organismo. Esto también es conocido como regulación epigenética. Algunos ejemplos de mecanismos epigenéticos son las modificaciones de histonas y la metilación del DNA. Estos cambios se han encontrado que son fuertemente influyentes en la incidencia de enfermedades cerebrales, desórdenes mentales, y adicción.[10] El control epigenético se ha demostrado que está involucrado en los altos niveles de plasticidad en el desarrollo temprano, de ese modo se define du importancia en el periodo crítico del organismo.[11] Algunos ejemplos de cómo los cambios en la epigenética pueden afectar al cerebro humano son:
- Niveles de metilación de los genes de rRNA más altos en el hipocampo resultando en una baja producción de proteínas y por tanto la limitada función hipocampal puede resultar en el deterioro del aprendizaje y la memoria y en tendencias suicidas.[12]
- En un estudio en donde compararon las diferencias genéticas entre personas sanas y pacientes psiquiátricos, se encontraron 60 marcadores epigenéticos diferentes asociados con la señalización en el cerebro.[12]
- Factores ambientales como el abuso infantil puede causas la expresión de un marcador epigenético en los receptores de glucocorticoides (asociados con la respuesta al estrés) que fue encontrado en víctimas suicidas.[12] Este es un ejemplo de plasticidad dependiente de experiencia.
- El enriquecimiento ambiental en individuos está asociado con el incremento de las histonas de acetilación de genes en el hipocampo y por tanto mejoran la consolidación de la memoria (notablemente la memoria espacial).[11]
Mecanismos moleculares de enfermedades neurodegenerativas[editar]
Excitotoxicidad y Receptores de glutamato[editar]
La excitotoxicidad es un fenómeno en el cual los receptores de glutamato son activados inapropiadamente. Puede ser causado por la prolongada transmisión excitatoria sináptica en la cual los altos niveles del neurotransmisor glutamato provocan una excesiva activación en la neurona postsináptica que puede derivar en la muerte de dicha neurona. En daño cerebral (como el de la isquemia), se ha encontrado que la excitotoxicidad es una causa significativa del daño cerebral. Esto puede ser entendible en el caso cuando haya una perfusión de sangre repentina después de haber reducido el flojo sanguíneo en el cerebro pudiendo provocar una actividad sináptica excesiva derivada del incremento de glutamato y aspartato durante el periodo de isquemia.[5][13]
Enfermedad de Alzheimer[editar]
La enfermedad de Alzheimer es la enfermedad neurodegenerativa más común y es también la demencia más común en las personas mayores. El desorden es caracterizado por la pérdida progresiva de la memoria y de varias funciones cognitivas. Se ha hipotetizado que la deposición de Beta-amiloide(40-42 residuos de aminoácidos) en el cerebro es integral en la incidencia de esta enfermedad. La acumulación de puede significar el bloqueo hipocampal de la potenciación de largo término. Es también posible que el receptor para oligómeros de Beta-amiloide puedan ser una prion.[14]
Enfermedad de Parkinson[editar]
La enfermedad de Parkinson es la segunda más común de las enfermedades neurodegenerativa. Es una enfermedad del movimiento hipocinético de los ganglios basales causada por la pérdida de neuronas dopaminérgicas en la sustancia negra del cerebro humano. La inhibición del flojo de salida de los ganglios basales no decrece, y entonces las neuronas motoras reguladas por el tálamo, no son activadas en el tiempo debido. Los síntomas específicos son rigidez, problemas de postura. Movimientos lentos, y temblores. El bloqueo del receptor GABA de las neuronas de la médula espinal hacia las células reticulares, provoca la inhibición de las neuronas motoras, similar los que ocurren en la enfermedad de Parkinson.[5]
Enfermedad de Huntington[editar]
La Enfermedad de Huntington es una enfermedad del movimiento hipocinético de los ganglios basales causada por la pérdida de la inducción de la inhibición normal de las neuronas de la médula espinal de los ganglios basales. Este posee los efectos contrarios con los asociados con la enfermedad de Parkinson, incluyendo la inapropiada activación de las neuronas motoras. Como con los mecanismos GABAnérgicos observados en relación con la enfermedad de Parkinson, un agonista de GABA inyectado en las células de sustancia negra disminuye la inhibición de las neuronas motoras, resultando en movimientos involuntarios repentinos, similares a los síntomas de la enfermedad de Huntington.[5]
Referencias[editar]
- ↑ a b c d e f g h i j k l Molecular Neuroscience. Garland Science. 1998. ISBN 978-1859962503.
- ↑ «What are Neurotransmitters?». Archivado desde el original el 25 de septiembre de 2019. Consultado el 1 de noviembre de 2013.
- ↑ Riddle, Donald (1998). C. Elegans II. Nueva York: Cold Spring Harbor Laboratory Press. ISBN 978-0879695323.
- ↑ Hodgkin, Allan L.; Andrew F. Huxley (1952). «The dual effect of membrane potential on sodium conductance in the giant axon of Loligo». The Journal of Physiology 116 (4): 497-506. PMID 14946715. Archivado desde el original el 25 de marzo de 2020. Consultado el 25 de octubre de 2014.
- ↑ a b c d e f g h Purves, Dale (2012). Neuroscience (5th edición). Massachusetts, USA: Sinauer Associates, Inc. p. 80. ISBN 978-0-87893-695-3.
- ↑ Kamb, Alexander; Linda E. Iverson; Mark A. Tanouye (31 de julio de 1987). «Molecular characterization of Shaker, a Drosophila gene that encodes a potassium channel». Cell Press 50 (3): 405-413. PMID 2440582. doi:10.1016/0092-8674(87)90494-6.
- ↑ Davies, R. Wayne; Brian J. Morris (1997). Molecular Biology of the Neuron. Oxford, UK: BIOS Scientific Publishers Ltd. ISBN 1859962408.
- ↑ Dipolo, R.; C. Caputo; F. Bezanilla (marzo de 1983). «Voltage-dependent calcium channel in the squid axon». Proc Natl Acad Sci U S A. 80 (6): 1743-1745. PMC 393680. PMID 6300873. doi:10.1073/pnas.80.6.1743.
- ↑ a b Jazin, E.; Cahill, L. (enero de 2010). «Sex differences in molecular neuroscience: from fruit flies to humans». Nature Reviews Neuroscience 11 (1): 9-17. PMID 20019686. doi:10.1038/nrn2754.
- ↑ «Epigenetics and the Human Brain». Genetics Science and Learning Center at The University of Utah. Consultado el 10 de noviembre de 2013.
- ↑ a b Fagiolini, Michela; Catherin L. Jensen; Frances A. Champagne (2009). «Epigenetic Influences on brain development and plasticity». Current Opinion in Neurobiology 19: 1-6. Archivado desde el original el 22 de junio de 2010. Consultado el 14 de noviembre de 2013.
- ↑ a b c Tsankova, N.; W. Renthal, A. Kumar, E.J. Nextler (2007). «Epigenetic Regulation in Psychiatric Disorders». Nature Reviews Neurosciene 8 (5): 355-367. doi:10.1038/nrn2132. Consultado el 13 de noviembre de 2013.
- ↑ Lau, A.; M. Tymianski (2010). «Glutamate receptors, neurotoxicity and neurodegeneration». Pflugers Arch 460 (2): 525-542. PMID 20229265. doi:10.1007/s00424-010-0809-1.
- ↑ Laren, Juha; David A. Gimbel; Haakon B. Nygaard; John W. Gilbert (febrero de 2009). «Cellular prion protein mediates impairment of synaptic plasticity by amyloid-β oligomers». Nature 457 (7233): 1128-1132. PMID 19242475. doi:10.1038/nature07761. Consultado el 18 de noviembre de 2013.
