Síndrome de Hunter
| Síndrome de Hunter | ||
|---|---|---|
| Especialidad | endocrinología | |
| Sinónimos | ||
| Mucopolisacaridosis tipo II | ||
El síndrome de Hunter, o mucopolisacaridosis tipo II (MPS II), es una tesaurismosis, es decir, una enfermedad de almacenamiento lisosomal causada por una enzima ausente o deficiente, llamada iduronato-2-sulfatasa (I2S). El síndrome recibe el nombre del médico Charles A. Hunter (1873-1955), que la describió por primera vez en 1917. Nacido en Escocia, Hunter emigró a Canadá y tuvo una consulta médica en Winnipeg, Manitoba.
Generalidades[editar]
El síndrome de Hunter (MPS II), es una afección genética grave que afecta primariamente a varones. Interfiere con la capacidad del organismo para descomponer y reciclar algunos mucopolisacáridos específicos, conocidos también como glucosaminoglucanos o GAGs. Pertenece a un grupo relacionado de enfermedades de almacenamiento lisosómico.
En el síndrome de Hunter, el GAG se acumula en las células de todo el organismo debido a la deficiencia o a la ausencia de la enzima iduronato-2-sulfatasa (I2S). Esta acumulación interfiere con la función de ciertas células y órganos conduciendo a la aparición de varios síntomas graves. A medida que progresa la acumulación, los síntomas se hacen más aparentes. Las manifestaciones suelen consistir en diferentes rasgos faciales, macrocefalia y abdomen prominente. Los pacientes pueden también experimentar pérdida de audición, estenosis de las válvulas cardíacas que conducen a un fallo de la función del corazón, enfermedad obstructiva de las vías aéreas, apnea del sueño e hipertrofia hepática y del bazo. También puede verse afectada la capacidad de movimiento del paciente. En algunos casos el sistema nervioso central se ve afectado hasta el punto de que se producen retrasos en el desarrollo y problemas neurológicos. No todos los pacientes están afectados del mismo modo e igualmente el curso varía ampliamente. No obstante, el síndrome siempre es grave, progresivo y reduce la esperanza de vida.
Diagnóstico[editar]
Los signos y síntomas visibles del síndrome de Hunter en niños son normalmente las primeras pistas que llevan al diagnóstico. Este suele producirse entre los 2 y 4 años de edad. Los médicos emplean test de laboratorio para obtener pruebas adicionales de la presencia de una MPS antes de efectuar un diagnóstico definitivo midiendo la actividad de la I2S. Para ello se efectúa un análisis de orina para comprobar la presencia de GAGs. Es importante advertir que el test de orina para los glucosaminoglucanos pueden dar falsos negativos y el diagnóstico definitivo viene dado por la actividad de la I2S sérica, de los leucocitos o de los fibroblastos tomados en una biopsia de la dermis. Los resultados de este análisis determinan la gravedad del síndrome a partir de los patrones de actividad de la enzima. Es posible realizar un diagnóstico prenatal en muestras de líquido amniótico o en tejido tomado de las vellosidades coriónicas.
Etiología: genética[editar]
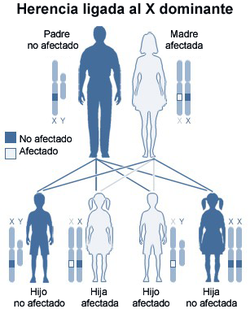
Ya que el síndrome de Hunter es un síndrome hereditario recesivo ligado al cromosoma X que afecta principalmente a varones, se transmite de una generación a otra de un modo específico. La homocigosis es extraordinariamente rara, de modo que basta una sola copia funcional en el gen X para evitar la aparición del síndrome en mujeres. No obstante, los varones tienen una sola copia de X, de modo que la madre portadora tiene un 50 % de probabilidades de transmitir el gen a la descendencia masculina.
Los síntomas del síndrome de Hunter (MPS II) no aparecen generalmente en el momento del nacimiento, sino que suelen comenzar a ser evidentes tras el primer año de vida. Entre los primeros síntomas con frecuencia aparecen hernias inguinales, infecciones del oído, moqueo y resfriados. Ya que estos síntomas son bastante comunes en todos los niños, es probable que no se acuda todavía a consulta para efectuar un diagnóstico de síndrome de Hunter. A medida que continúa la acumulación de GAG, comienzan a aparecer las manifestaciones físicas, entre ellas una tosquedad de rasgos faciales, con frente prominente, nariz con puente aplanado y lengua alargada. Algunos niños poseen estos mismos rasgos sin padecer el síndrome. Los pacientes también tienen un abdomen agrandado y macrocefalia. Muchos continúan padeciendo infecciones de repetición en los oídos y en el tracto respiratorio.
Bioquímica[editar]
El organismo humano depende de un gran abanico de reacciones químicas para mantener funciones críticas como la producción de energía, el crecimiento y desarrollo, la comunicación intercelular y la inmunidad. Una de esas funciones es la catabolización de biomoléculas grandes, que es el problema que subyace al síndrome de Hunter y que está relacionado con las enfermedades de almacenamiento.
Las alteraciones bioquímicas tienen lugar en una parte del tejido conectivo conocido como matriz extracelular. Esta se compone de diferentes azúcares y proteínas que contribuyen a la estructura global del organismo. La matriz rodea las células del cuerpo mediante una red organizada funcionando como un cemento que mantiene juntas las células. Uno de los componentes de la matriz es una biomolécula grande llamada proteoglucano. Como muchos componentes biológicos necesita periódicamente ser descompuesto y reemplazado. El resultado de esta descomposición son los mucopolisacáridos, también conocidos como GAGs. Existen muchos tipos de estos últimos, cada uno de ellos ubicados en lugares característicos.
En el síndrome de Hunter el problema se extiende a la descomposición de dos GAGs, el dermatán sulfato y el heparán sulfato, puesto que se necesita la I2S para que esto suceda. Los pacientes de Síndrome de Hunter, al tener la enzima inactiva o defectuosa, acaban acumulando grandes cantidades de heparán y dermatán sulfato. A medida que progresa la acumulación, esta interfiere con las funciones que posteriormente conducen a la aparición de los síntomas. La tasa de acumulación no es idéntica para todos los afectados, con lo cual aparece un amplio espectro de manifestaciones clínicas.
Signos y síntomas[editar]
Los síntomas del síndrome de Hunter (MPS II) no aparecen generalmente en el momento del nacimiento, sino que suelen comenzar a ser evidentes tras el primer año de vida. Entre los primeros síntomas con frecuencia aparecen hernias inguinales, infecciones del oído, moqueo y resfriados. Ya que estos síntomas son bastante comunes en todos los niños, es probable que no se acuda todavía a consulta para efectuar un diagnóstico de síndrome de Hunter. A medida que continúa la acumulación de GAG, comienzan a aparecer las manifestaciones físicas, entre ellas una tosquedad de rasgos faciales, con frente prominente nariz con puente aplanado y lengua alargada. Algunos niños poseen estos mismos rasgos sin padecer el síndrome. Los pacientes también tienen un abdomen agrandado y macrocefalia. Muchos continúan padeciendo infecciones de repetición en los oídos y en el tracto respiratorio.
El almacenamiento continuo de glucosaminoglucanos en las células acaba afectando a los órganos de un modo importante. El adelgazamiento de las válvulas y las paredes del corazón acaba produciendo insuficiencia. También se acaban adelgazando las paredes de las vías aéreas, produciendo afecciones respiratorias del sueño, así como una limitación de la capacidad pulmonar. A medida que aumenta el tamaño del hígado se produce una distensión del ombligo, apreciándose mejor las hernias. Las articulaciones principales pueden verse afectadas, lo que da lugar a problemas de movilidad, en especial en el pulgar e índice, lo cual limita la capacidad de asir pequeños objetos. Cuando esto afecta a otras articulaciones, como las caderas y rodillas, aparece una creciente dificultad para caminar con normalidad. Puede aparecer el síndrome del túnel carpiano dejando la mano casi impedida. Los mismos huesos pueden verse afectados, lo cual repercute en una menor estatura.
También pueden aparecer lesiones cutáneas con aspecto de guijarro y tono ebúrneo en los miembros superiores e inferiores, además del dorso superior de algunos pacientes. La presencia o ausencia de lesiones cutáneas no es, sin embargo, un dato relevante a la hora de predecir la severidad del síndrome.
Finalmente, el almacenamiento de GAG en el cerebro puede conducir a un retraso en el desarrollo de las estructuras nerviosas, con el consiguiente retraso.
Se da un amplio abanico de gravedad en los síntomas del síndrome de Hunter. Es importante advertir que el término "leve" se usa por los médicos para comparar a los pacientes con el síndrome de Hunter, de modo que aunque los síntomas se describan así, siempre son bastante graves. Dos de las áreas más variables son el grado de retraso mental y la esperanza de vida. Algunos afectados no padecen retraso mental y viven hasta los 20 o 30 años. En ocasiones se ha informado de personas que han llegado a vivir hasta los 60 años. La calidad de vida puede ser alta en un gran número de personas y muchos adultos tienen una vida laboral activa. Por el contrario, otros afectados tienen un retraso mental grave y expectativas de vida de 15 años o menos.
Prevalencia[editar]
Existen aproximadamente 2000 personas afectadas en todo el mundo y unas 500 en los Estados Unidos.
Tratamiento[editar]
El tratamiento resulta dificultoso debido a la naturaleza tan específica de la enfermedad. Entre otras medidas están las siguientes:
Tratamiento paliativo[editar]
Dadas las circunstancias de la enfermedad y la ausencia de un tratamiento realmente eficaz, es importante recalcar la necesidad de un tratamiento paliativo contra los diversos síntomas. Su objetivo es reducir los efectos del deterioro de muchas funciones corporales. En este caso la cirugía y la psiquiatría juegan un papel crucial.
Trasplante medular[editar]
Durante mucho tiempo el tratamiento más eficiente era el del trasplante de médula. Tiene la ventaja de procurar una fuente nueva de I2S. Sin embargo, se considera que los resultados son, cuando menos, imperfectos.
Mientras que el tratamiento puede detener muchos de los síntomas, es completamente ineficaz con los neurológicos, de modo que aunque aumenta la expectativa y la calidad de vida, no resuelve las deficiencias mentales de los pacientes. Además, el trasplante medular es una intervención quirúrgica mayor con muchos efectos secundarios y riesgo para la vida del paciente, lo que ha hecho disminuir su aplicación en el tratamiento del síndrome de Hunter.
Elaprase[editar]
La FDA aprobó el 24 de julio de 2006 Elaprase (Idursulfasa) desarrollado por Shire Human Genetic Therapies Ltd. Como terapia de reemplazo de enzimas diseñada para sustituir la enzima I2S, la cual es escasa o inexistente en personas con el síndrome de Hunter.
Se trata de una forma purificada de la enzima lisosómica producida por tecnología de ADN recombinante en líneas celulares humanas. Posiblemente, la Elaprasa es uno de los medicamentos más caros jamás producidos, con un coste aproximado de unos 300 000 dólares (unos 205 500 €) por paciente y año.[1]
Los padres de pacientes del síndrome de Hunter deben saber que la terapia implica un estricto régimen de larga duración y transfusiones. Para niños hiperactivos, que en el caso del síndrome suelen ser la mayoría, esto supone una limitación considerable. De igual modo se debe tener en cuenta que el tratamiento es fuerte y permanente.
Los pacientes de los estudios médicos con ELAPRASE, realizados a la fecha son mayores de 5 años. Niños, adolescentes y adultos respondieron de forma similar al tratamiento con ELAPRASE. Para niños menores de 5 años, no se estableció la seguridad ni la efectividad del tratamiento con ELAPRASE.
Durante los ensayos clínicos, algunos pacientes sufrieron reacciones alérgicas inmediatas a las infusiones con ELAPRASE® (idursulfasa), las cuales fueron potencialmente peligrosas para la vida. Los pacientes que han presentado reacciones alérgicas graves podrían experimentar otra reacción alérgica aproximadamente 24 horas después de la reacción inicial y necesitan ser observados por más tiempo.
Aproximadamente la mitad de los pacientes en estudios clínicos generaron anticuerpos al tratamiento con ELAPRASE y aumentaron sus reacciones a la infusión. Se desconoce la relación entre la presencia de anticuerpos y la efectividad de ELAPRASE.
Casos famosos[editar]
El 24 de julio de 2004, Andrew Wragg, de 38 años, vecino de Worthing, West Sussex, Inglaterra, fue acusado de asfixiar a su hijo de 10 años con una almohada porque no podía soportar la discapacidad del niño que sufría síndrome de Hunter. El 13 de diciembre de 2005, Andrew Wragg fue absuelto por un jurado que determinó que no asesinó a su hijo. Wragg era un especialista en seguridad militar que admitió encontrarse bajo estrés tras volver de la guerra de Irak. Negó que hubiera asesinado a su hijo, pero adujo homicidio involuntario por tener disminuidas sus capacidades. Se dijo que el caso era «excepcional» y se condenó a Wragg por homicidio involuntario a dos años de prisión, suspendiendo posteriormente la pena. La juez del caso declaró que «no se ganaba nada» mandando a Wragg a prisión.[2][3][4]
En la ciudad de Arica, en Chile, también se reportó el caso de un niño de 3 años de edad de nombre Kemuel, conocido por su campaña para solicitar firmas y apoyo a través de Facebook y otros medios, con el fin de pedir al gobierno de Chile que ayude económicamente a la familia debido a los altos costos derivados de la enfermedad. El 26 de octubre de 2010, luego de que la embajada española no otorgara asilo humanitario al pequeño Kemuel Lobos, de 5 años, sus padres interpusieron un recurso de protección en contra del Ministerio de Salud de Chile.
Véase también[editar]
Referencias[editar]
- ↑ cbc.ca (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ "Father cleared of murdering son" (BBC News)
- ↑ "Former SAS soldier who smothered terminally ill son walks free" (The Guardian)
- ↑ "Review 'will clarify murder laws'" (BBC News)
- [1]
- Síndrome de Hunter en Medline Plus..
- Hunter CA: A rare disease in two brothers. Proceedings of the Royal Society of Medicine, Londres, 1917, 10: 104-116
- Fotello Terapia Elaprase en español (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
Enlaces externos[editar]
- Síndrome de Hunter en About.com Archivado el 29 de enero de 2012 en Wayback Machine.
- Asociación de afectados Hunterpatients.com
- Shire Human Genetic Therapies, fabricante tratamiento
