Inhibidor de la recaptación
Un inhibidor de recaptación (IR), también conocido como bloqueador de transportadores, es un medicamento que inhibe la recaptación mediada por transportadores plasmáticos de un neurotransmisor desde la sinapsis hacia la neurona presináptica, llevando a un incremento de concentraciones extracelulares del neurotransmisor y por lo tanto un aumento en la neurotransmisión.
Muchos fármacos utilizan la inhibición de la recaptación para ejercer sus efectos psicológicos y fisiológicos, incluyendo varios antidepresivos, ansiolíticos, estimulantes, y anorexígenos, entre otros. La mayoría de los inhibidores de la recaptación afectan los neurotransmisores monoamina serotonina, norepinefrina, y dopamina. También hay un número de medicamentos y químicos de investigación que actúan como inhibidores de la recaptación para otros neurotransmisores tales como la adenosina, GABA, glutamato, y los endocannabinoides.[1][2][3][4][5]
Mecanismo de acción[editar]
Sustratos del sitio activo del transportador[editar]
Se cree que los inhibidores de la recaptación estándares actúan simplemente como un sustrato competitivo que funciona ligándose directamente al transportador plasmático del neurotransmisor en cuestión.[6][7][8][9] Ellos ocupan el transportador en lugar del neurotransmisor respectivo y le impiden competitivamente ser transportado desde el terminal nervioso o sinapsis hacia la neurona presináptica. Con dosis suficientemente altas, la ocupación se llega hasta el 80-90%. A este nivel de inhibición, el transportador pierde eficiencia como evacuador del exceso de neurotransmisores de las sinapsis y esto causa un incremento sustancial en las concentraciones extracelulares del neurotransmisor y por lo tanto un aumento en la neurotransmisión total.
Sustratos del sitio alostérico del transportador[editar]
Alternativamente, algunos inhibidores de la recaptación se ligan a sitio alostérico e inhiben la recaptación indirectamente y no competitivamente.
La fenciclidina y fármacos relacionados tales como la benociclidina, tenociclidina, ketamina, y dizocilpina (MK-801), han sido demostrados de inhibir la recaptación de neurotransmisores monoamina.[10][11][12] Aparentan ejercer su inhibición al ligarse a sitios alostéricos vagamente caracterizados en cada uno de los transportadores de monoamina respectivos.[13][14][15][16][17] La benzatropina, fluoxetina, mazindol, y vanoxerina también se ligan a estos sitios y tienen propiedades similares.[13][17][18] Además de sus altas afinidades para el sitio activo de los transportadores de monoamina, varios sustratos de transportadores competitivos tales como la cocaína e indatralina también tienen una afinidad menor para estos sitios alostéricos.[15][17][18]
Algunos inhibidores selectivos de la recaptación de serotonina (ISRS) como la fluoxetina y el dextroenantiómero del citalopram parecen ser inhibidores alostéricos de la recaptación de serotonina.[19][20] En vez de ligarse al sitio activo del transportador de serotonina, ellos se ligan al sitio alostérico, que ejerce sus efectos al causar cambios conformacionales en la proteína transportadora, y así modulando la afinidad de los sustratos por el sitio activo.[19] Como resultado, el escitalopram ha sido comercializado como un inhibidor alostérico de la recaptación de serotonina. Cabe destacar, este sitio alostérico podría estar directamente relacionado con los anteriormente mencionados sitios de unión de la fenciclidina.[13][18]
Dos de los principios activos de la hierba medicinal Hypericum perforatum (hierba de San Juan) son la hiperforina y adhiperforina.[21][22] La hiperforina y adhiperforina son inhibidores de la recaptación de serotonina, norepinefrina, dopamina, GABA, y glutamato, y ejercen estos efectos alostéricamente al ligarse a y activando el potencial de receptor transitorio canal catiónico TRPC6.[22][23] La activación del TRPC6 induce la entrada de calcio (Ca2+) y sodio (Na+) hacia la célula, lo que provoca el efecto.[23]
Sustratos del transportador vesicular[editar]

Un segundo tipo de inhibidor de la recaptación afecta el transporte vesicular, y bloquea el reembalaje de neurotransmisores hacia las vesículas citoplasmáticas. A diferencia de los inhibidores plasmáticos de la recaptación, los inhibidores vesiculares de la recaptación no incrementan las concentraciones sinápticas de un neurotransmisor, sólo las concentraciones citoplasmáticas; a menos que, también actúe como un inversor del transportador plasmático vía la fosforilación de la proteína transportadora, también conocido como un agente liberador. Los inhibidores vesiculares de la recaptación puros tienden a disminuir las concentraciones sinápticas de un neurotransmisor, ya que el bloqueo del reembalaje de, y almacenamiento del neurotransmisor en cuestión lo deja vulnerable a la degradación vía enzimas tales como la monoaminooxidasa (MAO) que existen en el citoplasma. Con el transporte vesicular bloqueado, las reservas del neurotransmisor se agotan rápidamente.
La reserpina (Serpasil) es un inhibidor irreversible y competitivo del transportador vesicular de monoaminas 2 (VMAT2), y es un ejemplo clásico de un inhibidor vesicular de la recaptación.
Clases y ejemplos[editar]
Selectivo para un neurotransmisor[editar]
- Inhibidor de la recaptación de adenosina (AdoRI)
- Dilazep (Cormelian), dipiridamol (Persantine), hexobendina (Ustimon), pentoxifilina (Trental)
- Inhibidor de la recaptación de dopamina (DRI)
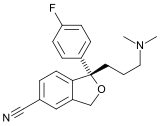
- Ácido amfonelico (AFA; WIN 25,978), benociclidina (BTCP; GK-13), RTI-121, RTI-229, troparil (β-CPT; WIN 35,065-2), vanoxerina (GBR-12,909)
- Inhibidor de la recaptación de endocannabinoide (eCBRI)
- Inhibidor de la recaptación de glutamato (GluRI) o inhibidor de la recaptación de aminoácido excitador (EAARI)
- Inhibidor de la recaptación de GABA (GRI)
- Deramciclano (EGIS-3886), ácido nipecótico, tiagabina (Gabitril)
- Inhibidor de la recaptación de glicina (GlyRI)
- Inhibidor de la recaptación de norepinefrina (NRI) or Adrenergic reuptake inhibitor (ARI)
- Atomoxetina (Strattera), nisoxetina (LY-94,939), reboxetina (Edronax, Vestra), viloxazina (Vivalan)
- Inhibidor de la recaptación de serotonina (SRI)
- Escitalopram (Lexapro, Cipralex), fluoxetina (Prozac), sertralina (Zoloft, Lustral)
Selectivo para varios neurotransmisores[editar]
- Inhibidor de la recaptación de serotonina y noradrenalina (SNRI)
- Desvenlafaxina (Pristiq), duloxetina (Cymbalta), milnacipran (Dalcipran, Ixel, Savella), venlafaxina (Effexor)
- Inhibidor de la recaptación de dopamina y noradrenalina (NDRI)
- Amineptina (Survector), bupropión (Wellbutrin, Zyban), metilenedioxipirovalerona, metilfenidato (Ritalin, Concerta), pipradrol (Meretran)
- Inhibidor de la recaptación de serotonina y dopamina (SDRI)
- Inhibidor de la recaptación de serotonina-noradrenalina-dopamina (SNDRI)
- Cocaína, indatralina (Lu-19-005), nefopam (Acupan), tesofensina (NS-2330)
- Inhibidor de la recaptación de serotonina-noradrenalina-dopamina-GABA-glutamato
Referencias[editar]
- ↑ Iversen L. (2006). «Neurotransmitter transporters and their impact on the development of psychopharmacology.». Br J Pharmacol. 147 (1): S82-88. PMC 1760736. PMID 16402124. doi:10.1038/sj.bjp.0706428.
- ↑ Pollack MH, Roy-Byrne PP, Van Ameringen M, Snyder H, Brown C, Ondrasik J, Rickels K (2005). «The selective GABA reuptake inhibitor tiagabine for the treatment of generalized anxiety disorder: results of a placebo-controlled study». J Clin Psychiatry. 66 (11): 1401-8. PMID 16420077. doi:10.4088/JCP.v66n1109.
- ↑ West AR, Galloway MP (1997). «Inhibition of glutamate reuptake potentiates endogenous nitric oxide-facilitated dopamine efflux in the rat striatum: an in vivo microdialysis study». Neurosci Lett. 230 (1): 21-4. PMID 9259454. doi:10.1016/S0304-3940(97)00465-5.
- ↑ Costa B, Siniscalco D, Trovato AE, Comelli F, Sotgiu ML, Colleoni M, Maione S, Rossi F, Giagnoni G (2006). «AM404, an inhibitor of anandamide uptake, prevents pain behaviour and modulates cytokine and apoptotic pathways in a rat model of neuropathic pain». Br J Pharmacol. 148 (7): 1022-32. PMC 1751928. PMID 16770320. doi:10.1038/sj.bjp.0706798.
- ↑ Boissard CG, Gribkoff VK (1993). «The effects of the adenosine reuptake inhibitor soluflazine on synaptic potentials and population hypoxic depolarizations in area CA1 of rat hippocampus in vitro». Neuropharmacology. 32 (2): 149-55. PMID 8383814. doi:10.1016/0028-3908(93)90095-K.
- ↑ Barker, Eric L.; Randy D. Blakely (1995). Norepinephrine and serotonin transporters: molecular targets of antidepressant drugs. In: Psychopharmacology: the fourth generation of progress.
- ↑ Sur C, Betz H, Schloss P. (1998). «Distinct effects of imipramine on 5-hydroxytryptamine uptake mediated by the recombinant rat serotonin transporter SERT1.». J Neurochem. 70 (6): 2545-2553. PMID 9603221. doi:10.1046/j.1471-4159.1998.70062545.x.
- ↑ Ravna AW, Sylte I, Dahl SG. (2003). «Molecular mechanism of citalopram and cocaine interactions with neurotransmitter transporters.». J Pharmacol Exp Ther. 307 (1): 34-41. PMID 12944499. doi:10.1124/jpet.103.054593.
- ↑ Apparsundaram S, Stockdale DJ, Henningsen RA, Milla ME, Martin RS. (2008). «Antidepressants targeting the serotonin reuptake transporter act via a competitive mechanism.». J Pharmacol Exp Ther. 327 (3): 982-990. PMID 18801947. doi:10.1124/jpet.108.142315.
- ↑ Pechnick RN, Bresee CJ, Poland RE (2006). «The role of antagonism of NMDA receptor-mediated neurotransmission and inhibition of the dopamine reuptake in the neuroendocrine effects of phencyclidine». Life Sci. 78 (17): 2006-11. PMID 16288927. doi:10.1016/j.lfs.2005.09.018.
- ↑ Nishimura M, Sato K, Okada T, Yoshiya I, Schloss P, Shimada S, Tohyama M (1998). «Ketamine inhibits monoamine transporters expressed in human embryonic kidney 293 cells». Anesthesiology 88 (3): 768-74. PMID 9523822. doi:10.1097/00000542-199803000-00029.
- ↑ Nishimura M, Sato K, Okada T, Schloss P, Shimada S, Tohyama M. (1998). «MK-801 blocks monoamine transporters expressed in HEK cells.». FEBS Lett. 423 (3): 376-380. PMID 9515743. doi:10.1016/S0014-5793(98)00126-4.
- ↑ a b c Akunne HC, Reid AA, Thurkauf A, Jacobson AE, de Costa BR, Rice KC, Heyes MP, Rothman RB. (1991). «[3H]1-[2-(2-thienyl)cyclohexyl]piperidine labels two high-affinity binding sites in human cortex: further evidence for phencyclidine binding sites associated with the biogenic amine reuptake complex.». Synapse. 8 (4): 289-300. PMID 1833849. doi:10.1002/syn.890080407.
- ↑ Rothman RB, Reid AA, Monn JA, Jacobson AE, Rice KC. (1989). «The psychotomimetic drug phencyclidine labels two high affinity binding sites in guinea pig brain: evidence for N-methyl-D-aspartate-coupled and dopamine reuptake carrier-associated phencyclidine binding sites.». Mol Pharmacol. 36 (6): 887-896. PMID 2557536.
- ↑ a b Goodman CB, Thomas DN, Pert A, Emilien B, Cadet JL, Carroll FI, Blough BE, Mascarella SW, Rogawski MA, Subramaniam S, et al. (1994). «RTI-4793-14, a new ligand with high affinity and selectivity for the (+)-MK801-insensitive [3H]1-]1-(2-thienyl)cyclohexyl]piperidine binding site (PCP site 2) of guinea pig brain.». Synapse. 16 (1): 59-65. PMID 8134901. doi:10.1002/syn.890160107.
- ↑ Rothman RB. (1994). «PCP site 2: a high affinity MK-801-insensitive phencyclidine binding site.». Neurotoxicol Teratol. 16 (4): 343-353. PMID 7968938. doi:10.1016/0892-0362(94)90022-1.
- ↑ a b c Rothman RB, Silverthorn ML, Baumann MH, Goodman CB, Cadet JL, Matecka D, Rice KC, Carroll FI, Wang JB, Uhl GR, et al. (1995). «Studies of the biogenic amine transporters. VI. Characterization of a novel cocaine binding site, identified with [125I]RTI-55, in membranes prepared from whole rat brain minus caudate.». J Pharmacol Exp Ther. 274 (1): 385-395. PMID 7616423.
- ↑ a b c Rothman RB, Cadet JL, Akunne HC, Silverthorn ML, Baumann MH, Carroll FI, Rice KC, de Costa BR, Partilla JS, Wang JB, et al. (1994). «Studies of the biogenic amine transporters. IV. Demonstration of a multiplicity of binding sites in rat caudate membranes for the cocaine analog [125I]RTI-55.». J Pharmacol Exp Ther. 270 (1): 296-309. PMID 8035327.
- ↑ a b Chen F, Larsen MB, Sánchez C, Wiborg O. (2005). «The S-enantiomer of R,S-citalopram, increases inhibitor binding to the human serotonin transporter by an allosteric mechanism. Comparison with other serotonin transporter inhibitors.». Eur Neuropsychopharmacol. 15 (2): 193-198. PMID 15695064. doi:10.1016/j.euroneuro.2004.08.008.
- ↑ Mansari ME, Wiborg O, Mnie-Filali O, Benturquia N, Sánchez C, Haddjeri N. (2007). «Allosteric modulation of the effect of escitalopram, paroxetine and fluoxetine: in-vitro and in-vivo studies.». Int J Neuropsychopharmacol. 10 (1): 31-40. PMID 16448580. doi:10.1017/S1461145705006462.
- ↑ Müller WE, Singer A, Wonnemann M (2001). «Hyperforin--antidepressant activity by a novel mechanism of action». Pharmacopsychiatry. 34 Suppl 1: S98-102. PMID 11518085.
- ↑ a b Chatterjee SS, Bhattacharya SK, Wonnemann M, Singer A, Müller WE (1998). «Hyperforin as a possible antidepressant component of hypericum extracts». Life Sci. 63 (6): 499-510. PMID 9718074. doi:10.1016/S0024-3205(98)00299-9.
- ↑ a b Leuner K, Kazanski V, Müller M, et al (diciembre de 2007). «Hyperforin--a key constituent of St. John's wort specifically activates TRPC6 channels». The FASEB journal : official publication of the Federation of American Societies for Experimental Biology 21 (14): 4101-11. PMID 17666455. doi:10.1096/fj.07-8110com.
