Hemodiálisis
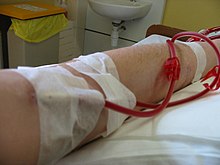

En medicina, la hemodiálisis es una terapia de sustitución renal que tiene como finalidad suplir parcialmente la función de los riñones. Consiste en extraer la sangre del organismo a través de un acceso vascular y llevarla a un dializador o filtro de doble compartimiento, en el cual la sangre pasa por el interior de los capilares en un sentido y el líquido de diálisis circula en sentido contrario, bañando dichos capilares. Así, ambos líquidos quedan separados por una membrana semipermeable. Este método consigue la circulación de agua y solutos entre la sangre y el baño para, entre otros fines, disminuir los niveles en sangre de sustancias tóxicas cuando están en exceso y que el riñón sano elimina, tales como el potasio y la urea. En pacientes oligúricos o anúricos también se programa la eliminación de una cantidad de agua de la sangre, ya que se va acumulando en los períodos interdiálisis por la incompetencia del riñón (fallo renal).
La hemodiálisis principalmente se realiza en instalaciones hospitalarias o en clínicas ambulatorias, con la presencia de personal sanitario con entrenamiento específico. Aunque es menos frecuente, la diálisis también se puede hacer en casa del paciente como hemodiálisis domiciliaria. En este caso se entrena a una persona para que ayude al paciente.
Se trata de un procedimiento que, salvo en fracaso renal agudo, puede preverse al avanzar el deterioro de la función renal. Para llevar a cabo el tratamiento de sustitución renal es necesario que el paciente cuente con un buen acceso vascular. Por ello, si no se cuenta con una fístula madura, al inicio, el médico debe prever la colocación de un catéter central temporal, ya sea MAHURKAR™ o Niágara, que permitirá el flujo necesario de sangre hasta contar con una FAVI (fístula arteriovenosa interna) nativa, una prótesis o, si esto no fuera posible, proceder a la colocación de un catéter permanente, ya sea el catéter GlidePath™ , Permcath™ o Palindrome™.
Prescripción[editar]

La prescripción para la diálisis por un nefrólogo (el médico especializado en el funcionamiento de los riñones) especificará varios parámetros para ajustar la máquina de diálisis, como el tiempo y la duración de las sesiones de diálisis, tamaño del dializador (es decir, el tamaño de la superficie), la tasa del flujo de sangre en diálisis y la tasa de flujo del dializado. En general, cuanto más grande sea el cuerpo de un individuo, más diálisis necesitará. En otras palabras, los individuos grandes típicamente requieren sesiones de diálisis más largas. Pero el paciente renal que va a ser ingresado al tratamiento dialítico de la función renal con hemodiálsis, debe de realizarse los siguientes estudios de laboratorio: Biometría hempática completa, química sanguínea, niveles séricos de sodio, potasio, calcio, fósforo y magnesio, tiempos de coagulación asi como pruebas de funcionamiento hepático completas, tipo y grupo sanguíneo. Serología para Hepatitis A, B y C y para HIV (virus de la inmunodeficiencia adquirida SIDA) así como una radiografía de Tórax para ver la colocación del catéter de diálisis (Mahurkar) y que este bien colocado.
En Estados Unidos y el Reino Unido son típicas las sesiones de cuatro horas, tres veces por semana, aunque hay pacientes que se dializan dos, cuatro o cinco veces por semana. También hay un número pequeño de pacientes que son sometidos a diálisis nocturna de hasta ocho horas por noche, durante seis noches por semana.
La decisión para iniciar diálisis o hemofiltración en pacientes con insuficiencia renal puede depender de varios factores, que se pueden dividir en indicaciones agudas o crónicas.
- Indicaciones agudas para diálisis o hemofiltración:
- Hiperpotasemia que es nivel elevado del potasio.
- Acidosis metabólica que es pH sistémico bajo.
- Sobrecarga de fluido (que usualmente se manifiesta como un edema pulmonar).
- Pericarditis urémica, una potencial complicación que amenaza la vida en una falla renal.
- Encefalopatía urémica severa originada por la falla renal y acumulamiento de urea en el Sistema Nervioso Central.
- En pacientes sin falla renal, envenenamiento agudo con toxinas dializables, como el litio.
- Indicaciones crónicas para la diálisis:
- Falla renal sintomática.
- Baja tasa de filtrado glomerular (GFR, por sus siglas en inglés) (La terapia de reemplazo renal a menudo recomendada para comenzar en una GFR de menos de 10 a 15mLs/min/1.73m²)
- Otros marcadores bioquímicos de inadecuada función renal en el contexto de una GFR (ligeramente) mayor que 15mL/min/1.73m². Esta sería generalmente la hiperfosfatemia que es resistente al tratamiento médico o a la anemia resistente al EPO en el contexto de una GFR no mucho mayor que 15mL/min/1.73m².
Efectos secundarios y complicaciones[editar]
La hemodiálisis a menudo implica la eliminación de líquido (a través de ultrafiltración), porque la mayoría de los pacientes con insuficiencia renal producen poca o nada de orina. Los efectos secundarios causados de la extracción de líquido en exceso o la eliminación de líquidos con rapidez excesiva incluyen hipotensión importante, fatiga, mareo, dolor de pecho, taquicardia, debilidad, calambres en las piernas, síndrome vertiginoso, náuseas y cefalea. Sin embargo, el impacto de cierta cantidad o tasa de eliminación de líquido puede variar mucho de persona a persona y día a día. Estos efectos secundarios se pueden evitar o mitigar, al llevar su dieta renal indicada, limitar la ingesta de líquidos entre los tratamientos o aumentar la dosis de diálisis, por ejemplo, dializar con mayor frecuencia que el tratamiento estándar de tres veces a la semana, con duración de tres a cuatro horas.
Debido a que la hemodiálisis requiere el acceso al sistema circulatorio, los pacientes que se someten a ella tienen un portal de entrada para los microbios, que puede evolucionar a septicemia o a infección severa que afecte las válvulas del corazón (endocarditis), (neumonitis), o el hueso (osteomielitis). El riesgo de infección depende del tipo de acceso usado (ver abajo). También puede haber hemorragia severa y el riesgo depende del tipo de acceso usado.
La coagulación de la sangre en los tubos y el dializador era causa frecuente de complicaciones hasta que se implementó el uso rutinario de anticoagulantes.[1] Pese a que los anticoagulantes han mejorado los resultados, no están libres de riesgos y pueden originar sangrado. Ocasionalmente, se presentan reacciones alérgicas severas a los anticoagulantes. De ser así, se prescinde del anticoagulante[2] o se suministra un anticoagulante alternativo.
La heparina es el anticoagulante más usado en pacientes con hemodiálisis, dado que generalmente se tolera bien y puede revertirse rápidamente con protamina. Una alternativa común a la heparina es el citrato, que se emplea en la unidad de cuidados intensivos y en los pacientes alérgicos a la heparina.
Accesorios o transductores[editar]
En hemodiálisis hay tres vías principales de acceso a la sangre:
- El catéter intravenoso
- La fístula de Cimino-Brescia arteriovenosa (AV)
- El injerto sintético (graft)
El tipo de acceso depende de factores como el curso previsto del tiempo de la falla renal de un paciente y la condición de su vascularidad. Los pacientes pueden tener múltiples accesos en un tiempo determinado, usualmente debido a que debe ser usado temporalmente un catéter para realizar la diálisis mientras se está madurando el acceso permanente, la fístula o el injerto arteriovenoso.
El catéter[editar]

El acceso de catéter, llamado a veces CVC (Catéter venoso central), consiste en un catéter plástico con dos luces, u ocasionalmente dos catéteres separados, que se introduce en una vena grande (generalmente la vena cava, vía la vena yugular interna o la vena femoral), para permitir que se retiren por una luz grandes flujos de sangre y entren al circuito de la diálisis y, una vez purificada, vuelva por la otra luz. Sin embargo, el flujo de la sangre es casi siempre menor que el de una fístula o un injerto funcionando bien.
Usualmente, se encuentran en dos variedades generales, intubado y no intubado.
El acceso de catéter no intubado es para corto plazo (hasta cerca de 10 días, pero a menudo solamente para una sesión de diálisis). El catéter emerge de la piel en el sitio de la entrada en la vena.
El acceso de catéter intubado implica un catéter más largo, que se intuba debajo de la piel desde el punto de inserción en la vena hacia un sitio de salida a una cierta distancia. Generalmente, se colocan en la vena yugular interna en el cuello y el sitio de salida está en la pared del pecho. El túnel actúa como barrera a los microbios invasores. Estos catéteres intubados se diseñan para acceso de término corto o medio (de semanas a meses), pues la infección sigue siendo un problema frecuente.
Aparte de la infección, otro problema serio con el acceso del catéter es la estenosis venosa. El catéter es un cuerpo extraño en la vena y a menudo provoca una reacción inflamatoria en la pared de la vena, que resulta en una cicatriz y un estrechamiento de la vena, a menudo a tal punto que se obstruye. Esto puede causar problemas de congestión venosa severa en el área drenada por la vena y puede también hacer la vena, y las venas drenadas por ella, inútiles para la formación de una fístula o de un injerto en una fecha posterior. Los pacientes en hemodiálisis de largo plazo pueden literalmente agotar los accesos, así que esto puede ser un problema fatal.
El acceso de catéter suele emplearse para acceso rápido para diálisis inmediata, para acceso entubado en pacientes que se considera que probablemente se recuperarán de una falla renal aguda y pacientes con falla renal terminal, que están esperando a que madure el acceso alternativo o los que no pueden tener acceso alternativo.
Usualmente, el acceso de catéter es popular entre los pacientes, pues el acceso a la máquina de diálisis no requiere agujas. Sin embargo, los serios riesgos del acceso de catéter, mencionados arriba, significa que tal tipo de acceso se debe contemplar como una solución a largo plazo solamente en la situación de acceso más desesperada.
La necesidad de acceso vascular en pacientes con enfermedad renal puede ser temporal o permanente. La necesidad de acceso temporal varía desde varias horas (diálisis única) a meses (si se utiliza durante un periodo de espera hasta la maduración de una fístula arteriovenosa). El acceso temporal se establece con la inserción percutánea de un catéter en una vena grande (yugular interna, femoral o, menos preferible, subclavia). La construcción de un acceso vascular permanente permite el acceso repetido al vaso de meses a años.
El acceso permanente ideal es aquel que suministra un flujo adecuado para la prescripción de diálisis, dura mucho tiempo y tiene una tasa más baja de complicaciones. Las FAV autólogas son las que mejor cumplen este criterio.
Accesos venosos.
Indicaciones:
- Accesos temporales. Los catéteres venosos se utilizan normalmente como accesos vasculares temporales en situaciones agudas en los siguientes pacientes: 1) pacientes con insuficiencia renal aguda; 2) pacientes que requieren hemodiálisis o hemoperfusión por intoxicación o sobredosis; 3) pacientes con insuficiencia renal crónica que necesitan una diálisis urgente, pero que no disponen de un acceso a la circulación maduro para su uso; 4) pacientes en hemodiálisis periódica que han perdido su acceso permanente y requieren de un acceso temporal hasta el restablecimiento de la función de otro acceso permanente; 5) pacientes que requieren plasmaféresis o hemoperfusión; 6) pacientes con diálisis peritoneal en periodo de descanso, hasta la colocación de un nuevo catéter peritoneal (generalmente, la retirada del catéter peritoneal se debe a peritonitis grave); 7) receptores de trasplante que necesitan hemodiálisis temporalmente durante un episodio de rechazo agudo o grave.
- Accesos permanentes. Los catéteres venosos con anclaje se están convirtiendo en una alternativa de acceso a la circulación de larga duración en pacientes en los que no puede crearse rápidamente un acceso AV. En este grupo de pacientes se incluyen niños pequeños, pacientes con diabetes y enfermedad renal grave, individuos con enfermedad renal mórbida y enfermos con múltiples accesos AV fallidos que no disponen de vasos adecuados para otro acceso AV. Otras indicaciones incluyen a pacientes con miocardiopatía incapaces de mantener la presión sanguínea o flujos adecuados del acceso y aquellos que requieren un acceso a la circulación más frecuente (hemodiálisis domiciliaria diaria nocturna).
Sin embargo, el flujo de sangre inadecuado es un problema importante de los catéteres venosos. Raramente, se consiguen flujos nominales mayores de 400 mL/min y generalmente el flujo se limita a 300 mL/min. Esto limita el uso de catéteres venosos permanentes en los pacientes de complexión mayor, pues produce una tasa de reducción menor y un aclaramiento fraccional de urea no efectivo (KtV).
La fístula arteriovenosa[editar]
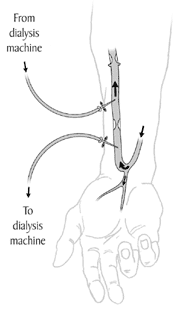
Las fístulas de Cimino arteriovenosas son reconocidas como el método de acceso más adecuado. Para crear una fístula arteriovenosa, un cirujano vascular une una arteria con una vena a través de anastomosis. Puesto que esto enlaza los vasos capilares, la sangre fluye en una tasa muy alta a través de la fístula. Esto se puede sentir colocando un dedo sobre una fístula madura, se percibirá como un "zumbido" o un "ronroneo”. Esto se llama frémito (thrill). Las fístulas se crean generalmente en el brazo no dominante y se pueden situar en la mano (la fístula 'Snuffbox' o 'tabacalera'), el antebrazo (usualmente una fístula radio cefálica, en la cual la arteria radial se anastomosa con la vena cefálica) o el codo (usualmente una fístula braquicéfala, donde la arteria braquial / humeral se anastomosa con la vena cefálica). Una fístula necesitará un número de semanas para "madurar", en promedio de cuatro a seis semanas. Una vez madura, podrá usarse para realizar la hemodiálisis. Durante el tratamiento, se insertan dos agujas en la fístula, una para drenar la sangre y llevarla a la máquina de diálisis y otra para retornarla.
Las técnicas utilizadas para la punción de la fístula arteriovenosa son las siguientes: Punción por área (un área determinada para la punción venosa y otra para la punción arterial), punción en escala (una a continuación de la otra, utilizando la superficie de la fístula arteriovenosa en toda su longitud) y punción en ojal (punciones en el mismo sitio).[3]
Las ventajas del uso de la fístula arteriovenosa son índices de infección más bajos, puesto que no hay material extraño implicado en su formación, caudales más altos de sangre (que se traduce en una diálisis más eficaz), y una incidencia más baja de trombosis. Las complicaciones son pocas, pero si una fístula tiene un flujo muy alto en ella, y la vasculatura que provee el resto del miembro es pobre, entonces puede ocurrir el síndrome del robo, donde la sangre que entra en el miembro es atraída dentro de la fístula y retornada a la circulación general sin entrar en los vasos capilares del miembro. Esto da lugar a extremidades frías de ese miembro, calambres dolorosos, y si es grave, en daños del tejido fino. Una complicación a largo plazo de una fístula arteriovenosa puede ser el desarrollo de una protuberancia o aneurisma en la pared de la vena, donde la pared de la vena es debilitada por la repetida inserción de agujas a lo largo del tiempo. El riesgo de desarrollar un aneurisma se puede reducir en gran medida por una técnica cuidadosa al poner la aguja. Los aneurismas pueden necesitar cirugía correctiva y puede acortar la vida útil de una fístula.
En el cateterismo con una mala técnica de limpieza se puede producir una miocarditis, lo que puede ocasionar la muerte.
El injerto arteriovenoso (Graft)[editar]

En la mayoría de los aspectos, los injertos arteriovenosos son bastante parecidos a las fístulas, excepto que usan una vena artificial para juntar la arteria y la vena. Estas venas artificiales se hacen de material sintético, a menudo PTFE (Goretex). Los injertos son usados cuando la vascularidad nativa del paciente no permite una fístula, maduran más rápidamente que las fístulas y pueden estar listos para usarse días después de la formación. Sin embargo, tienen alto riesgo de desarrollar estrechamiento donde el injerto se ha suturado a la vena. Como resultado del estrechamiento, ocurren a menudo la coagulación o la trombosis. Como material extraño, tienen mayor riesgo de infección. Por otro lado, las opciones de sitios para poner un injerto son más grandes debido al hecho de que el injerto se puede hacerse muy largo. Así que pueden ser colocados en el muslo o aun el cuello (el injerto de collar).
Equipo[editar]

La máquina de hemodiálisis es un producto sanitario que realiza la función de bombear la sangre del paciente y el dializado a través del dializador. Las máquinas de diálisis más recientes del mercado están altamente computarizadas y monitorizan continuamente un conjunto de parámetros de seguridad críticos, incluyendo tasas de flujo de la sangre y el dializado, la presión sanguínea, el ritmo cardíaco, el O2, la conductividad, el pH, etc. Si alguna lectura está fuera del rango normal, sonará una alarma audible para avisar al técnico que está supervisando el cuidado del paciente. Los fabricantes más grandes de máquinas de diálisis son Fresenius, Gambro, Nipro. Baxter y B.Braun.
Una parte importante de los equipos siempre es verificar que las rutinas de limpieza y desinfección internas y externas tengan un estricto sistema de control favorecido por agentes químicos desinfectantes. Para garantizar la seguridad del paciente, estos deben de llevarse a cabo con la periodicidad, según la necesidad y el uso de los equipos considerando sus características y especificaciones del fabricante para que así también se optimice la vida del equipo.
Sistema de agua[editar]

Un extenso sistema de purificación del agua es absolutamente crítico para la hemodiálisis. Puesto que los pacientes de diálisis están expuestos a vastas cantidades de agua que se mezcla con el baño ácido para formar el dializado, incluso pueden filtrarse en la sangre trazas de minerales contaminantes o endotoxinas bacterianas. Debido a que los riñones dañados no pueden realizar su función prevista de quitar impurezas, los iones que se introducen en la corriente sanguínea por vía del agua pueden aumentar hasta niveles peligrosos, causando numerosos síntomas, incluyendo la muerte. Por esta razón, el agua usada en hemodiálisis es típicamente purificada usando ósmosis inversa. También es revisada para confirmar no contiene iones de cloro y cloraminas, y su conductividad es continuamente monitoreada, para detectar el nivel de iones en el agua.
Dializador[editar]
El dializador, o riñón artificial, es un producto sanitario y es la pieza del equipo que filtra la sangre. Uno de los tipos más populares es el dializador hueco de fibra, en el cual la sangre corre a través de un paquete de tubos capilares muy finos, y el dializado se bombea en un compartimiento que baña las fibras. El proceso mimetiza la fisiología del glomérulo renal y el resto del nefrón. Los gradientes de presión son usados para remover líquido de la sangre. La membrana en sí misma a menudo es sintética, hecha de una mezcla de polímeros como poliariletersulfona, poliamida y polivinilpirrolidona. Los dializadores vienen en muchos tamaños diferentes. Un dializador más grande generalmente se traducirá en una mayor área de membrana, y por lo tanto, en un aumento en la cantidad de solutos removidos de la sangre del paciente. Diferentes tipos de dializadores tienen diversos aclaramientos (clearance) para diferentes solutos. El nefrólogo prescribirá el dializador a ser usado dependiendo del paciente. El dializador puede ser tanto desechado como reutilizado después de cada tratamiento. Si es reutilizado, hay un procedimiento extenso de esterilización. Cuando se reutilizan, los dializadores no son compartidos entre pacientes.
Tampoco debe ser compartido ningún tipo de catéter, ya que el mismo puede transmitir agentes patógenos infecciosos que podrían ser fatales para el paciente tratado.
Véase también[editar]
- Diálisis renal
- Hemodiálisis domiciliaria
- Diálisis peritoneal
- Hemofiltración
- Hemodiafiltración
- Terapias extracorpóreas
- Terapia de reemplazo renal
- Descripción de la hemodiálisis paso a paso
- Producto sanitario
- Electromedicina
- NORMA Oficial Mexicana NOM-003-SSA3-2010, Para la práctica de la hemodiálisis.
Referencias[editar]
- ↑ Janssen M, van der Meulen J (1996). «The bleeding risk in chronic haemodialysis: preventive strategies in high-risk patients.». Neth J Med 48 (5): 198-207. PMID 8710039.
- ↑ Raja R, Kramer M, Rosenbaum J, Bolisay C, Krug M. «Hemodialysis without heparin infusion using Cordis Dow 3500 hollow fiber.». Proc Clin Dial Transplant Forum 10: 39-42. PMID 7346852.
- ↑ Hemodiálisis Práctica para Enfermeras y Estudiantes de Enfermería (Rosario Vargas Herrera) Pags. 59 Agregado por Yadhira Jiménez R
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Hemodiálisis.
Wikimedia Commons alberga una categoría multimedia sobre Hemodiálisis.- Diálisis Peritoneal Dialisisperitoneal.org Página líder en castellano dedicada a la divulgación de información acerca de la diálisis.
- Insuficiencia renal: Cómo escoger el tratamiento que más le conviene
- Your Kidneys and How They Work - (American) National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), NIH
- Treatment Methods for Kidney Failure - (American) National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), NIH
- Treatment Methods for Kidney Failure: Hemodialysis Archivado el 31 de diciembre de 2010 en Wayback Machine. - (American) National Kidney and Urologic Diseases Information Clearinghouse, NIH
- What is dialysis? - Kidney Foundation of Canada
- Global Dialysis Global Directory of dialysis centers
- InfoRenal Información en castellano sobre insuficiencia renal y sus tratamientos.
- Hemodiálisis Información en castellano sobre el tratamiento de hemodiálisis
- Diálisis Peritoneal Domiciliaria Página en castellano dedicada a la divulgación de información acerca de los distintos tratamientos renales sustitutivos.
- National Kidney Foundation Información en varios idiomas sobre todos los aspectos de la Insuficiencia Renal y sus tratamientos (dieta, diálisis, trasplante, etc.)
- Diálisis y Hemodiálisis Diferencias entre una Diálisis y Hemodiálisis
- Paciente Renal Blog en castellano del Hospital General Universitario de Valencia orientado a la enfermedad renal: tratamientos, recetas e historias de pacientes.
- La hemodialisis veterinaria, una oportunidad de supervivencia para perros y gatos
