Fisicoquímica orgánica
La fisicoquímica orgánica o química física orgánica es el estudio de las relaciones entre la estructura y la reactividad de las moléculas orgánicas. De forma más específica, la fisicoquímica orgánica aplica las herramientas experimentales de la física química al estudio de las moléculas orgánicas y provee un marco teórico que interpreta la influencia de las estructuras tanto en mecanismos de reacción como en las velocidades de reacción de reacciones orgánicas. Se puede considerar como un subcampo que conecta la química orgánica con la física química. El término «fisicoquímica orgánica» fue acuñado por Louis Plack Hammet en 1940 al usar dicha frase como título de un libro de texto.[1][2]
Los químicos físicos orgánicos utilizan técnicas experimentales como la espectroscopia, espectrometría, cristalografía, química computacional y química cuántica para estudiar tanto las velocidades de las reacciones orgánicas como la relativa estabilidad química de los reactivos iniciales, sus estados de transición y los productos finales.[3] Los químicos de este campo trabajan para entender las bases físicas de la Química orgánica moderna. Por lo tanto, la Físicoquímica orgánica tiene aplicaciones en áreas especializadas tales como la química de polímeros, la química supramolecular, etc.[3] Además, muchos Premios Nobel de química han sido por trabajos realizados en la química física orgánica, cabiendo destacar los del año 2013: Martin Karplus (por sus estudios teórico-prácticos sobre la estructura de las proteínas gracias a la aplicación de su ecuación de Karplus en RMN), Michael Levitt y Arieh Warshel por el desarrollo de modelos a multiescala para complejos sistemas químicos.[4]
Estructura química y termodinámica[editar]
Termoquímica[editar]
Los químicos orgánicos utilizan las herramientas de la termodinámica para estudiar los enlaces, la estabilidad y la energía de los sistemas químicos. Esto incluye experimentos para medir y determinar la entalpía (), la entropía () y la energía libre de Gibbs () de una reacción, una transformación química o una isomerización. Los químicos utilizan diversos análisis químicos y matemáticos para hallar estos valores.
Para predecir la estabilidad de las moléculas y el cambio en la entalpía a través del curso de una reacción, se utilizan constantes empíricas como la energía de disociación de enlace, la entalpía de formación () y el calor de combustión (). Para moléculas complejas, el valor de puede no estar disponible. Sin embargo, puede estimarse usando fragmentos moleculares con entalpías de formación conocidas. Este tipo de análisis, conocido como BGIT (del inglés Benson group increment theory, «teoría del incremento de grupos de Benson») fue desarrollado por Sidney Benson, quien dedicó su carrera a desarrollar el concepto.[3][5][6]
La termoquímica de reactivos intermedios —carbocationes, carbaniones y radicales libres— es también interesante para los químicos orgánicos. Para sistemas químicos que emplean radicales libres hay disponibles datos de incremento de grupos.[3] Se pueden conseguir estabilidades de carbocationes y carbaniones usando afinidades iónicas de hidruro y valores de pKa, respectivamente.

Análisis conformacional[editar]
Uno de los principales métodos para evaluar la estabilidad química y la energética es el análisis conformacional. Los fisicoquímicos orgánicos utilizan el análisis conformacional para evaluar los diferentes tipos de tensiones presentes en una molécula para predecir los productos de la reacción.[7] Dichas tensiones pueden encontrarse tanto en moléculas cíclicas como acíclicas, manifestándose en varios sistemas como tensión torsional, tensión alílica, tensión anular y tensión sin-pentano.[3] Los valores A proveen una base cuantitativa para predecir la conformación de un ciclohexano sustituido, una clase importante de compuestos orgánicos cíclicos cuya reactividad está guiada fuertemente por efectos conformacionales. El valor A es la diferencia en la energía libre de Gibbs entre las formas axiales y ecuatoriales del ciclohexano sustituido. Al añadir los valores A de varios sustituyentes, se puede predecir la conformación preferida por un derivado del ciclohexano.
Además de la estabilidad molecular, el análisis conformacional se utiliza para predecir los productos de reacciones. Un ejemplo comúnmente citado del uso de este análisis es la reacción de eliminación bimolecular (E2). Esta reacción ocurre inmediatamente cuando el nucleófilo ataca la especie que es antiperiplanar al grupo saliente. El análisis del orbital molecular A para este fenómeno sugiere que esta conformación otorga el mejor traslape entre los electrones en el orbital de enlace R-H σ, que se encuentra bajo un ataque nucleofílico, y el antienlace vacío σ* del enlace R-X que está siendo roto.[8] Con este efecto, puede usarse el análisis conformacional para diseñar moléculas que tengan reactividad mejorada.
Los procesos físicos que originan las barreras de rotación de enlaces son complejas, y estas barreras han sido estudiadas extensivamente a través de métodos experimentales y teóricos.[9][10][11] Algunos artículos recientes han investigado el predominio de las contribuciones estéricas, electrostáticas e hiperconjugativas a las barreras rotacionales en el etano, butano y otras moléculas sustituidas.[12]
Interacciones no covalentes[editar]

Los químicos utilizan el estudio de interacciones o enlaces no covalentes intramoleculares e intermoleculares para evaluar la reactividad. Dichas interacciones incluyen enlaces de hidrógeno, interacciones electrostáticas entre moléculas cargadas, interacciones dipolo-dipolo, interacciones π, interacciones catión-π, apilamiento, química donante-aceptor y enlaces de halógeno. Además, el efecto hidrofóbico —la asociación de compuestos orgánicos en agua— es una interacción electrostática no covalente de interés para los químicos. El origen físico preciso del efecto hidrofóbico proviene de muchas interacciones complejas, pero se cree que es el componente más importante del reconocimiento molecular en el agua.[3][13] La fuerte interacción entre el ácido fólico y el receptor folato ha sido atribuida tanto a enlaces de hidrógeno como a interacciones hidrofóbicas. El estudio de las interacciones no covalentes es usado también para estudiar enlaces y cooperatividad in estructuras supramoleculares y compuestos macrocíclicos como éter de corona y criptandos, los cuales pueden actuar como anfitriones para moléculas huéspedes.

Reacciones ácido-base[editar]
Las propiedades de los ácidos y las bases son relevantes para la Fisicoquímica orgánica. Los químicos orgánicos están interesados principalmente en ácidos-bases de Brønsted-Lowry como donantes o aceptores de protones y en ácidos y bases de Lewis como donantes o aceptores de electrones. Los químicos usan una serie de factores desarrollados a partir de la Física Química (electronegatividad, efecto inductivo, energía de disociación de enlaces, resonancia química, hibridación de orbitales, aromaticidad y solvatación) para predecir acideces y basicidades relativas.
El principio ácido-base duro-blando se utiliza para predecir interacciones moleculares y la dirección de reacción. En general, las interacciones entre moléculas del mismo tipo son preferentes. En otras palabras, los ácidos duros se asociarán con bases duras, y los ácidos blandos con bases blandas. El concepto de ácidos duros y bases es frecuentemente utilizado en la síntesis de entidades de coordinación inorgánicos.
Cinética[editar]
Los fisicoquímicos orgánicos utilizan las bases matemáticas de la cinética química para estudiar las velocidades y mecanismos de reacción. A diferencia de la termodinámica, la cual se enfoca más a las estabilidades relativas () de productos y reactivos y sus concentraciones de equilibrio; el estudio de la cinética se enfoca en la energía de activación () —la diferencia de energía libre entre la estructura reactante y la estructura en estado de transición— de una reacción y, por lo tanto, permite a un químico estudiar los procesos de equilibrio químico.[3] Normalmente en química orgánica se aplican formalismos derivados matemáticamente, como el postulado de Hammond, el principio de Curtin-Hammett y la teoría de reversibilidad microscópica. Los químicos han usado también el principio del control de reacción cinético y termodinámico.
Ecuaciones de velocidad[editar]
El estudio de la cinética química se usa para determinar la ecuación de velocidad de una reacción. Dicha ecuación permite conocer la relación cuantitativa entre la velocidad de una reacción química y las concentraciones o presiones parciales de las especies químicas presentes en dicha reacción.[14] Las ecuaciones de velocidad deben determinarse a través de mediciones experimentales; generalmente no pueden ser deducidas a partir de la ecuación química. La ecuación de velocidad determinada experimentalmente da indicio de la estequiometría de las estructuras en los estados de transición, relacionados con la estructura en estado fundamental. La determinación de la ecuación de velocidad fue obtenida históricamente al monitorizar la concentración de un reactivo a lo largo de una reacción a través de un análisis gravimétrico. Hoy en día, esto se hace casi exclusivamente por el uso de técnicas espectroscópicas rápidas y sin ambigüedades. En la mayoría de los casos, la determinación de las ecuaciones de velocidad se simplifica al añadir un buen exceso de todos los reactivos excepto uno (el reactivo limitante).
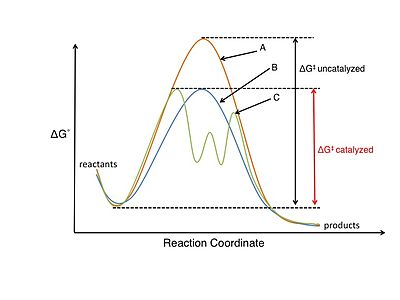
Catálisis[editar]
El estudio de la catálisis y las reacciones catalíticas es muy importante para el campo de la fisicoquímica orgánica. Un catalizador participa en la reacción química pero no se consume en el proceso.[14] El catalizador baja la barrera de la energía de activación (), aumentando la velocidad de reacción, ya sea estabilizando la estructura del estado de transición o desestabilizando una reacción intermedia clave. Puesto que sólo se necesita una pequeña cantidad de catalizador, este mismo puede dar acceso fácil a moléculas orgánicas que de otra forma serían caras y difíciles de sintetizar. Los catalizadores también pueden influir en las velocidades de reacción cambiando el mecanismo de reacción.[3]
Efecto isotópico cinético[editar]
Aun cuando una ecuación de velocidad dé la estequiometría de la estructura del estado de transición, esta no da ninguna información acerca de la ruptura o la formación de enlaces.[3] La sustitución de un isótopo cerca de una posición reactiva da como resultado un cambio en la velocidad de reacción. La sustitución isotópica cambia la energía potencial de los intermedios de la reacción y los estados de transición porque los isótopos más pesados forman enlaces más fuertes con otros átomos que los átomos más ligeros. La masa atómica afecta el punto cero del estado vibracional de las moléculas asociadas. Se forman enlaces más cortos y más fuertes en las moléculas con isótopos más pesados y enlaces más débiles en las moléculas con isótopos más ligeros.[15] Dado que los movimientos vibracionales suelen cambiar a menudo en el transcurso de una reacción, debido a la creación y la ruptura de los enlaces, las frecuencias estarán afectadas y la sustitución de un isótopo puede dar idea del mecanismo de reacción y de la ecuación de velocidad.
Efectos de los sustituyentes[editar]
El estudio de la forma en que los sustituyentes afectan a la reactividad de una molécula o a la velocidad de reacción es de gran interés para los químicos. Los sustituyentes pueden ejercer un efecto a través de interacciones estéricas y electrónicas. Entre estas últimas destacan la resonancia y los efectos inductivos. La polarizabilidad de la molécula también puede verse afectada. La mayor parte de los efectos de los sustituyentes se analizan a través de las relaciones lineales de la energía libre (LFRE, por sus siglas en inglés). La más común de estas es el análisis del diagrama de Hammett.[3] Este análisis compara el efecto de varios sustituyentes en la ionización del ácido benzoico con sus impactos en diferentes sistemas químicos. Los parámetros de los diagramas de Hammett son sigma (σ) y rho (ρ). El valor de σ indica la acidez del ácido benzoico sustituido con relación a la forma sin sustituir. Un valor positivo de σ indica que el compuesto es más ácido, mientras que un valor negativo indica que la versión sustituida es menos ácida. El valor de ρ es una medida de la sensitividad de la reacción al cambio del sustituyente, pero solamente mide efectos inductivos. Por esta razón se produjeron dos nuevas escalas para evaluar la estabilización de la carga localizada, a través de resonancia. Una es σ+, que trata con los sustituyentes que estabilizan la carga positiva por medio de resonancia. La otra es σ- que es para los grupos que estabilizan las cargas negativas por resonancia. El análisis de Hammett puede usarse para ayudar a entender los mecanismos posibles de una reacción. Por ejemplo, si se predice que la estructura en estado de transición tiene una composición de carga negativa relativa a la estructura en el estado base, entonces se esperaría que los grupos donantes de electrones incrementen la tasa de la reacción.[3]
Se han desarrollado otras escalas LFRE. Los efectos estéricos y polares se han analizado a través de los parámetros de Taft. Si se cambia el disolvente en lugar del reactivo, se puede obtener información de los cambios durante la reacción. El diagrama de Grunwald-Winstein dae información cuantitativa de estos efectos.[3][16]

Efectos de los disolventes[editar]
Los disolventes pueden tener un poderoso efecto en la solubilidad, la estabilidad química y la velocidad de reacción. Un cambio en el disolvente puede permitir a los químicos ejercer influencia en el control termodinámico o cinético de la reacción. Las reacciones ocurren a diferentes velocidades en distintos disolventes debido al cambio en la distribución de carga durante una transformación química. Los disolventes puede influir tanto al reactivo como al estado de transición.[3] Un ejemplo del efecto del disolvente es la comparación de las reacciones SN1 y SN2.
Los disolventes pueden tener también un efecto significativo en el equilibrio termodinámico de un sistema. Un ejemplo típico de esto es la tautomerización ceto-enol: en disolventes apróticos no polares la forma enol está fuertemente favorecida debido a la formación de enlaces de hidrógeno intramoleculares, mientras que en disolventes apróticos polares, como el cloruro de metileno, la forma enol está menos favorecida debido a la interacción entre el disolvente polar y la dicetona polar. En disolventes próticos, el equilibrio se encuentra cerca de la forma ceto conforme el enlace de hidrógeno intramolecular compite con los enlaces de hidrógeno que se originan desde el disolvente.[18][19][20]
Un ejemplo moderno del estudio de los efectos de los disolventes en el equilibrio químico puede verse en el estudi de Carlier et al. acerca de la epimerización de reactivos de Grignard de ciclopropilnitrilo quiral.[17] En este estudio se muestra que la constante de equilibrio para la isomerización de cis a trans del reactivo de Grignard es mucho mayor (es decir, la preferencia para la forma cis se incrementa) en tetrahidrofurano (THF) sobre éter dietílico. Sin embargo, una velocidad más rápida de isomerización de cis a trans en THF da como resultado una pérdida de pureza estereoquímica. Entender la configuración molecular de reactivos como estos es particularmente importante para mejorar la selectividad en síntesis asimétricas.
Química cuántica[editar]
Muchos de los aspectos de la relación entre estructura y reactividad se pueden racionalizar a través de la resonancia, el empuje de electrones, los efectos inductivos, la regla del octeto y la hibridación de orbitales s-p. Pero estos son únicamente formalismos útiles y no representan la realidad física. Debido a estas limitaciones, un verdadero entendimiento de la fisicoquímica orgánica requiere una aproximación más rigurosa, basada en la física de partículas. La química cuántica da un marco teórico riguroso capaz de predecir las propiedades de las moléculas a través del cálculo de la estructura electrónica molecular, y se ha convertido en una herramienta muy útil para los fisicoquímicos orgánicos disponible directamente como paquetes de software.[21] La capacidad de la Química cuántica está construida sobre el modelo ondulatorio del átomo, en el cual, el núcleo atómico es muy pequeño y es una esfera cargada positivamente, rodeada de una nube difusa de electrones. Las partículas se definen a través de su función de onda asociada, una ecuación que contiene toda la información acerca de dicha partícula.[14] Toda la información acerca del sistema está contenida en la función de onda. Esta información se extrae de ella utilizando operadores matemáticos.
La energía asociada con una función de onda en particular puede extraerse resolviendo la ecuación de Schrödinger:
La forma de la ecuación anterior, es llamada la ecuación de Schrödinger independiente del tiempo, (en esta, es la función de onda, es la energía en la cual se aplica un operador hamiltoniano[14] () apropiado). En varias formas de la ecuación de Schrödinger, el tamaño general de la distribución de probabilidad de la partícula se incrementa con menores masas. Por esta razón, los núcleos son de tamaño despreciable en comparación con los electrones, que son mucho más ligeros. En aplicaciones prácticas en la Química cuántica, los núcleos son tratados como cargas puntuales.
Debido a las complejas interacciones que resultan de la repulsión electrón-electrón, las soluciones a la ecuación de Schrödinger son posibles solamente para sistemas con un solo electrón, como el átomo de hidrógeno, la molécula ion hidrógeno H2+, los átomos hidrogenoides He+, Li2+, etc. Sin embargo, a partir de estos modelos simples, surgen todos los orbitales atómicos (s,p,d,f...) y los orbitales de enlace (σ,π...). En sistemas con muchos electrones, una función de onda general multielectrónica describe las propiedades de todos los electrones a la vez. Dichas funciones de onda se generan a través de añadir linealmente funciones de onda de electrones individuales para generar una suposición inicial. Esta última es modificada repetidas veces hasta que la energía asociada se minimiza. Algunas veces se requieren miles de suposiciones hasta que se halle una solución satisfactoria. Por esta razón, estos cálculos son realizados por superordenadores de gran potencia. Es importante señalar que las soluciones para átomos con muchos electrones dan propiedades como el diámetro y la electronegatividad, los cuales se asemejan bastante a los datos experimentales y a los patrones hallados en la tabla periódica. Las soluciones para moléculas, como el metano, dan representaciones exactas de su estructura electrónica, las cuales no se pueden obtener por métodos experimentales.[22] En lugar de cuatro enlaces σ del carbono a cada átomo de hidrógeno, la teoría predice un conjunto de cuatro orbitales de enlace, los cuales están deslocalizados a través de toda la molécula. De manera similar, la verdadera estructura electrónica del 1,3-butadieno muestra orbitales moleculares de enlace π deslocalizados que se estiran a través de toda la molécula, en vez de dos enlaces dobles aislados, como predice la estructura de Lewis.[23]
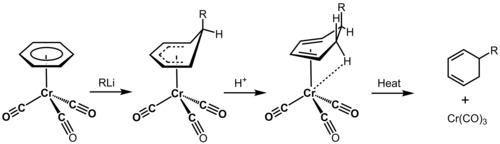
Una estructura electrónica completa ofrece un gran poder de predicción para las transformaciones y dinámica orgánicas, especialmenete en casos donde se tenga moléculas aromáticas, sistemas de enlaces π, enlaces entre metales y moléculas orgánicas, moléculas que contienen heteroátomos no comunes como el selenio y el boro, y la dinámica conformacional de moléculas grandes como las proteínas, en las cuales las diversas aproximaciones en los formalismos químicos hacen que la predicción de la estructura y reactividad sea imposible. Un ejemplo de la utilidad de la determinación de la estructura electrónica para los fisicoquímicos orgánicos es la desaromatización, catalizada por un metal, del benceno. El bencenocromotricarbonilo es altamente electrófilo, debido al retiro de la densidad electrónica de los orbitales d del cromo hacia los orbitales antienlazantes del monóxido de carbono, y es capaz de enlazarse de forma covalente a la cara del benceno a través de los orbitales moleculares deslocalizados. Los ligandos del CO retiran electrones de forma inductiva del benceno a través del átomo de cromo, y activan dramáticamente el benceno para un posterior ataque nucleófilo. Los nucleófilos son capaces de reaccionar para crear hexaciclodienos, los cuales pueden utilizarse en transformaciones posteriones como cicloadiciones de Diels Alder.[24]
La química cuántica también permite conocer el mecanismo de una transformación orgánica sin la necesidad de ningún dato experimental. Dado que las funciones de onda dan la energía libre de un estado molecular dado, las geometrías supuestas de las moléculas pueden optimizarse para dar las estructuras relajadas, muy similares a las que se encuentran por métodos experimentales.[25] De esa manera, se pueden simular las coordenadas de reacción y se pueden resolver las estructuras en el estado de transición. Por lo tanto, es posible resolver la superficie de energía completa para una reacción dada. Tales cálculos se han aplicado a muchos problemas en química orgánica, en donde los datos de la cinética no están disponibles o son difíciles de obtener.[3]
Espectroscopia, espectrometría, y cristalografía[editar]
La Fisicoquímica orgánica a menudo requiere la identificación de estructuras moleculares, dinámica, y concentración de reactivos durante una reacción. La interacción de las moléculas con la luz puede proporcionar una gran cantidad de datos acerca de dichas propiedades, a través de experimentos espectroscópicos no destructivos, con la luz absorbida cuando la energía de un fotón es igual a la diferencia de energías entre dos niveles energéticos en una molécula y con luz emitida cuando un estado excitado en una molécula colapsa a uno de menor energía. Las técnicas espectroscópicas se suelen clasificar de acuerdo al tipo de excitación que se está estudiando, como las excitaciones vibracionales, rotacionales, electrónicas, resonancia magnética nuclear y resonancia paramagnética electrónica. Además de los datos espectroscópicos, la determinación de la estructura es complementada por datos obtenidos a partir de difracción de rayos X, análisis elemental y espectrometría de masa.[26]

Espectroscopia por RMN y RPE[editar]
Una de las herramientas más poderosas en la fisicoquímica orgánica es la espectroscopia de resonancia magnética nuclear (RMN). Un campo magnético externo aplicado a ciertos núcleos genera dos estados discretos con valores de espín positivo y negativo de diferente energía. La diferencia de energías puede establecerse por medio de la frecuencia de la luz que se necesita para excitar un núcleo u que cambie el estado de espín para un valor dado del campo magnético. Los núcleos que no son indistinguibles en una determinada molécula absorben a diferentes frecuencias, y el área integrada bajo el pico en el espectro de RMN es proporcional al número de núcleos que responden a esa frecuencia.[27] Es posible cuantificar la concentración relativa de diferentes moléculas orgánicas simplemente por integración de los picos en el espectro. De esta manera, muchos experimentos de cinética pueden llevarse a cabo de forma fácil y rápida siguiendo el progreso de una reacción dentro de una muestra de RMN. La espectroscopia de resonancia magnética nuclear de protón se utiliza a menudo para estudiar compuestos sintéticos, puesto que los protones asociados a ciertos grupos funcionales tienen energías de absorción características. No obstante, la espectroscopia de RMN puede realizarse en isótopos de nitrógeno, carbono, flúor, fósforo, boro y otros elementos. Además de los experimentos simples de absorción, también es posible determinar la velocidad de reacción de intercambio rápido de átomos a través de mediciones de intercambio de supresión, distancias entre átomos a través de experimentos de efecto Overhauser nuclear multidimensionales y acoplamiento espín-espín a través de enlace por medio de espectroscopia de correlación homonuclear.[28] Asimismo, además de las propiedades de excitación de los espines de los núcleos, es posible estudiar las propiedades de radicales orgánicos usando la misma técnica fundamental. Los electrones que no están en pares tienen también un espín neto, por lo que un campo magnético externo permite la extracción de información similar a través de espectroscopia de resonancia paramagnética electrónica (RPE).[3]

Espectroscopia vibracional[editar]
La espectroscopia infrarroja (IR), o espectroscopia vibracional, permite la identificación de grupos funcionales y, debido a su bajo costo y robustez, es usada comúnmente en laboratorios de enseñanza y en el monitoreo en tiempo real del progreso de reacciones en ambientes difíciles de alcanzar (altas presiones, altas temperaturas, límites de fase de gases). Las vibraciones moleculares están cuantizadas, al igual que las funciones de onda electrónicas, con incrementos enteros en la frecuencia, lo que lleva a mayores niveles de energía La diferencia entre niveles de energía vibracionales es prácticamente constante y a menudo cae en el rango de energía que corresponde a fotones infrarrojos, porque a temperaturas normales, las vibraciones moleculares son similares a las de un oscilador armónico. Esto permite la identificación cruda de grupos funcionales en moléculas orgánicas, pero los espectros se complican por el acoplamiento vibracional entre grupos funcionales cercanos en moléculas complejas. Por esta razón su utilidad al determinar las estructuras está comúnmente limitada a moléculas simples. Algunas otras complicaciones son que ciertas vibraciones no inducen un cambio en el momento dipolar molecular, y no serán observables a través de la espectroscopia de absorción IR típica. En lugar de ello, estas vibraciones pueden estudiarse a través de espectroscopia Raman. Sin embargo, esta técnica requiere un aparato más elaborado y es menos utilizada por lo general. No obstante, como la espectroscopia Raman requiere dispersión de luz, esta puede realizarse en muestras microscópicas como en la superficie de un catalizador en catálisis heterogénea, una frontera de fase o en una submuestra de microlitros dentro de un volumen de líquido mayor.[26] Las aplicaciones de la espectroscopia vibracional son utilizadas a menudo por los astrónomos para estudiar la composición de nubes moleculares, atmósferas de planetas extrasolares y superficies planetarias.
Espectroscopia por excitación de electrones[editar]
La espectroscopia por excitación de electrones, o espectroscopia ultravioleta-visible (UV-vis), se realiza en las regiones visible y ultravioleta del espectro electromagnético. Esta técnica es útil para investigar la diferencia en energía entre los orbitales moleculares ocupados de energía más alta (HOMO, del inglés highest occupied molecular orbital) y los orbitales desocupados de menor energía (LUMO, del inglés lowest unoccupied molecular orbit). Esta información es útil para los fisicoquímicos orgánicos en el diseño de sistemas fotoquímicos orgánicos y tintes, ya que la absorción de diferentes longitudes de onda de luz visible da a las moléculas orgánicas su color. Por ello, un entendimiento detallado de la estructura electrónica es de ayuda al explicar las excitaciones electrónicas. A través de un control cuidadoso de la estructura molecular es posible sintonizar la banda HOMO-LUMO para obtener los colores deseados y sus propiedades de los estados excitados.[29]
Espectrometría de masas[editar]
La espectrometría de masas es una técnica que permite la medición de la masa molecular y ofrece datos complementarios a las técnicas espectroscópicas para la identificación estructural. En un experimento típico una muestra de una fase gaseosa de un material orgánico gas se ioniza y la especie iónica resultante se acelera por medio de un campo eléctrico aplicado hacia dentro de un campo magnético. La desviación de la trayectoria ocasionada por el campo magnético, y muchas veces también el tiempo que tarda la molécula en alcanzar el detector, es usada para calcular la masa de la misma. Frecuentemente, en el transcurso de la ionización de una muestra, las moléculas de mayor tamaño se rompen, por lo que los datos resultantes muestran el ion molecular y una serie de fragmentos. Esta fragmentación puede dar una gran idea de la secuencia en polímeros como proteínas y ácidos nucleicos. Además de la masa de una molécula y sus fragmentos, la distribución de masas de las variedades isotópicas puede también determinarse y la presencia cualitativa de ciertos elementos se pueden identificar por su distribución isotópica natural que los caracteriza. El cociente de la población de fragmentos obtenida puede compararse sobre la población de iones originales de compuestos analizados previamente en una librería de datos empíricos de fragmentación y relacionarlo con esa estructura molecular conocida.[30] Se utiliza una cromatografía de gases-espectroscopia de masas combinada para identificar cualitativamente las moléculas y para medir cuantitativamente la concentración con gran precisión. Esto es muy usado para examinar pequeñas cantidades de biomoléculas y narcóticos ilícitos en muestras de sangre. Para los químicos orgánicos sintéticos es una herramienta útil para la caracterización de nuevos compuestos y productos de reacción.

Cristalografía[editar]
A diferencia de los métodos espectroscópicos, la cristalografía de rayos X permite siempre la determinación sin ambigüedad de la estructura, y da los ángulos de enlace y las longitudes de manera precisa, mientras que a través de la espectroscopia esta información suele ser completamente inaccesible.
Esta técnica se utiliza frecuentemente en la fisicoquímica orgánica para conseguir una geometría molecular absoluta y es una herramienta importante para mejorar la síntesis de sustancias enantioméricas puras. Es también la única manera de identificar la posición y los enlaces de elementos que carecen de un núcleo activo en RMN, como el oxígeno. De hecho, antes de que los métodos de determinación estructural por rayos X estuviesen disponibles a principios del siglo XX, todas las estructuras orgánicas eran meras conjeturas. Por ejemplo, la geometría molecular tetraédrica del carbono fue confirmada únicamente a través de la estructura cristalina del diamante,[31] y la estructura deslocalizada del benceno fue confirmada a través de la estructura cristalina del hexametilbenceno.[32] Aunque la cristalografía da como resultado datos altamente satisfactorios, no es una técnica de uso diario en la química orgánica, ya que es necesario hacer crecer un monocristal perfecto de un compuesto objetivo. Solamente las moléculas más complejas, para las cuales no es posible interpretar los datos de NMR sin ambigüedad, requieren de esta técnica. En el ejemplo de la figura, la estructura del complejo anfitrión-huésped habría sido bastante difícil de obtener sin una estructura monocristalina: no existen protones en el fullereno y, sin enlaces covalentes entre las dos mitades del complejo orgánico, la espectroscopia por sí sola no habría sido capaz de sondear la estructura hipotética.
Referencias[editar]
- ↑ Hammett, Louis P. (1940) Physical Organic Chemistry New York: McGraw Hill.
- ↑ Hammond, George S. (1997). «Physical organic chemistry after 50 years: It has changed, but is it still there?». Pure and Applied Chemistry 69 (9): 1919-22.
- ↑ a b c d e f g h i j k l m n ñ Dougherty, Eric V. Anslyn ; Dennis A. (2006). Modern physical organic chemistry (Dodr. edición). Sausalito, Calif.: University Science Books. ISBN 978-1-891389-31-3.
- ↑ Nobel Media AB (8 de febrero de 2014). «All Nobel Prizes in Chemistry» (en inglés). Nobel Prize Foundation. Consultado el 9 de febrero de 2014.
- ↑ Cohen, N.; Benson, S. W. (1 de noviembre de 1993). «Estimation of heats of formation of organic compounds by additivity methods». Chemical Reviews 93 (7): 2419-2438. doi:10.1021/cr00023a005.
- ↑ Benson, Sidney W.; Cruickshank, F. R.; Golden, D. M.; Haugen, Gilbert R.; O'Neal, H. E.; Rodgers, A. S.; Shaw, Robert; Walsh, R. (1 de junio de 1969). «Additivity rules for the estimation of thermochemical properties». Chemical Reviews 69 (3): 279-324. doi:10.1021/cr60259a002.
- ↑ --, Francis A. Carey. (2008). Organic chemistry (7th ed. -- edición). Boston, [Mass.]: McGraw-Hill Higher Education. ISBN 978-0-07-304787-4.
- ↑ Isaacs, Neil S. (1995). Physical organic chemistry (2nd ed. edición). Burnt Mill, Harlow, Essex, England: Longman Scientific & Technical. ISBN 0-58221863-2.
- ↑ Mo, Yirong; Gao, Jiali (1 de febrero de 2007). «Theoretical Analysis of the Rotational Barrier of Ethane». Accounts of Chemical Research 40 (2): 113-119. doi:10.1021/ar068073w.
- ↑ Liu, Shubin (7 de febrero de 2013). «Origin and Nature of Bond Rotation Barriers: A Unified View». The Journal of Physical Chemistry A 117 (5): 962-965. doi:10.1021/jp312521z.
- ↑ Liu, Shubin; Govind, Niranjan (1 de julio de 2008). «Toward Understanding the Nature of Internal Rotation Barriers with a New Energy Partition Scheme: Ethane and-Butane». The Journal of Physical Chemistry A 112 (29): 6690-6699. doi:10.1021/jp800376a.
- ↑ Yamamoto, Takuhei; Chen, Pi-Yu; Lin, Guangxin; Błoch-Mechkour, Anna; Jacobsen, Neil E.; Bally, Thomas; Glass, Richard S. (1 de octubre de 2012). «Synthesis and rotation barriers in 2, 6-Di-( -anisyl) anisole». Journal of Physical Organic Chemistry 25 (10): 878-882. doi:10.1002/poc.2939.
- ↑ Chen, Chen; Ke, Jiyuan; Zhou, X. Edward; Yi, Wei; Brunzelle, Joseph S.; Li, Jun; Yong, Eu-Leong; Xu, H. Eric et al. (14 de julio de 2013). «Structural basis for molecular recognition of folic acid by folate receptors». Nature 500 (7463): 486-489. doi:10.1038/nature12327.
- ↑ a b c d Simon, Donald A. McQuarrie; John D. (1997). Physical chemistry: a molecular approach (Rev. ed. edición). Sausalito, EUA.: Univ. Science Books. ISBN 978-0-935702-99-6.
- ↑ Isaacs, Neil S. (1995). Physical organic chemistry (2.ª ed. edición). Essex, England: Longman Scientific & Technical. ISBN 0-582-21863-2.
- ↑ Kevill, Dennis N.; D'Souza, Malcolm J. (1992). «Concerning the development of scales of solvent ionizing power based on solvolyses of benzylic substrates». Journal of Physical Organic Chemistry 5 (6): 287-294. doi:10.1002/poc.610050602.
- ↑ a b Gao, Ming; Patwardhan, Neeraj N.; Carlier, Paul R. (2013). «Stereochemical Inversion of a Cyano-Stabilized Grignard Reagent: Remarkable Effects of the Ethereal Solvent Structure and Concentration». Journal of the American Chemical Society 135 (38): 14390-14400. doi:10.1021/ja407348s.
- ↑ Mills, Sander G.; Beak, Peter (1985). «Solvent effects on keto-enol equilibria: tests of quantitative models». The Journal of Organic Chemistry 50 (8): 1216-1224. doi:10.1021/jo00208a014.
- ↑ Emsley, John; Freeman, Neville J. (1987). «β-diketone interactions». Journal of Molecular Structure 161: 193-204. doi:10.1016/0022-2860(87)85074-3.
- ↑ Schlund, Sebastian; Basílio Janke, Eline M.; Weisz, Klaus; Engels, Bernd (2009). «Predicting the tautomeric equilibrium of acetylacetone in solution. I. The right answer for the wrong reason?». Journal of Computational Chemistry. doi:10.1002/jcc.21354.
- ↑ «Gaussian Website». Consultado el 21 de enero de 2014.
- ↑ Paula,, Peter Atkins,... Julio de (2010). Physical chemistry. (9th ed. edición). Nueva York: W. H. Freeman and Co. ISBN 9781429218122.
- ↑ Atkins, P. W. (1991). Physical chemistry (4.ª ed., reimpr. con correcciones. edición). Oxford [etc.]: Oxford University Press. p. 62. ISBN 9780198552840.
- ↑ Semmelhack, M. F.; Hall, H. T.; Yoshifuji, M. (1976). «.eta.5-Cyclohexadienyltricarbonylchromium(0) intermediates in the reaction of carbanions with .eta.6-arenetricarbonylchromium(0)». Journal of the American Chemical Society 98 (20): 6387-6389. doi:10.1021/ja00436a056.
- ↑ III, Henry F. Schaefer (2004). Quantum chemistry : the development of ab initio methods in molecular electronic structure theory. Mineola, EUA: Dover Publications. ISBN 0-486-43246-7.
- ↑ a b Drago, Russell S. (1992). Physical methods for chemists (2.ª ed. edición). Ft. Worth: Saunders College Pub. ISBN 0030751764.
- ↑ James Keeler. «Chapter 2: NMR and energy levels» (reimpreso en la Universidad de Cambridge). Understanding NMR Spectroscopy. University of California, Irvine. Consultado el 26 de octubre de 2013.
- ↑ Keeler, James (2010). Understanding NMR spectroscopy (2nd ed. edición). Chichester: Wiley. ISBN 978-0-470-74608-0.
- ↑ Reusch, William. «Visible and Ultraviolet Spectroscopy». Michigan State University Website. Michigan State University. Consultado el 26 de octubre de 2013.
- ↑ Adlard, Edward R. (2000). Alan J. Handley,, ed. Gas chromatographic techniques and applications. Boca Raton, EUA: CRC Press. p. 168. ISBN 0-8493-0514-4.
- ↑ Bragg, W. H.; Bragg, W. L. (1913). «The Structure of the Diamond». Nature 91 (2283): 557-557. doi:10.1038/091557a0.
- ↑ Lonsdale, K. (1928). «The Structure of the Benzene Ring». Nature 122 (3082): 810-810. doi:10.1038/122810c0.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Physical organic chemistry» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.











