Enantiómero
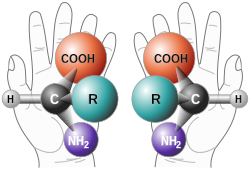

En química, los enantiómeros (del griego 'ἐνάντιος', enántios, "opuesto", y 'μέρος', méros, "parte" o "porción"), también llamados isómeros ópticos, son una clase de estereoisómeros tales que en la pareja de compuestos la molécula de uno es imagen especular de la molécula del otro y no son superponibles. Cada uno de ellos tiene, en su nombre, la letra correspondiente: R (del latín rectus, derecho) o S (del latín sinister, izquierdo).[1] Los compuestos enantiopuros son muestras que poseen, dentro de los límites de detección, solo una de las dos moléculas quirales.[2]
Propiedades[editar]
Las dos formas enantiómeras tienen las mismas propiedades físicas excepto la interacción con la luz polarizada en un plano. Puede ser que un isómero desvíe el plano de polarización hacia la derecha, mientras el otro isómero lo desvíe en la dirección contraria; sin embargo, esta propiedad óptica no está relacionada en absoluto con el tipo de enantiómero, es decir, si la molécula es un enantiómero D o L, sino con el carácter levógiro o dextrógiro de la molécula; pudiendo ser L-dextrógiro o L-levógiro o un D-dextrógiro o D-levógiro.

También tienen las mismas propiedades químicas, excepto si reaccionan con otras moléculas quirales. De hecho, los enantiómeros son moléculas quirales. Por eso, presentan actividad biológica muy diferente ya que la mayoría de las moléculas presentes en los seres vivos son quirales. Por ejemplo, la R(-)adrenalina es más potente que la S(+)adrenalina.[4]
La mezcla en cantidades equimolares de cada enantiómero en una disolución se denomina mezcla racémica, o racemato. Las mezclas racémicas son ópticamente inactivas debido a que los efectos polarizantes de cada enantiómero se anulan con los del enantiómero complementario. Si un enantiómero (R) polariza la luz 20º hacia la derecha, el enantiómero (S) la polarizará 20º hacia la izquierda.
Se obtienen mezclas racémicas como producto de algunas reacciones químicas. Son especialmente frecuentes en los casos que presentan intermediarios de geometría plana, cuando la probabilidad de que un reactivo choque con la molécula por un lado es igual a la probabilidad de que choque por el otro. En el caso de reactivos orgánicos, un carbono puede adoptar geometría plana si tiene hibridación sp2 o si se trata de un carbocatión. En el siguiente caso se ilustra la reacción de un carbocatión plano con aniones bromuro, para dar [(2R)-2-bromobutan-2-il]benceno y [(2S)-2-bromobutan-2-il]benceno en cantidades idénticas:
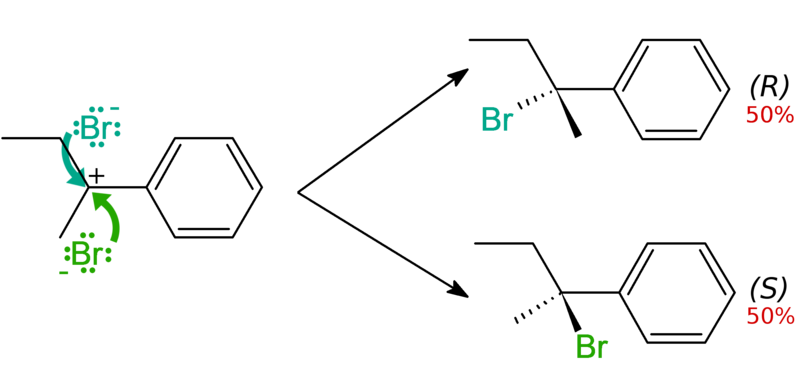
El producto es, por tanto, una mezcla racémica. Los mecanismos de reacción E1 y SN1 producen intermediarios catiónicos, lo que suele dar lugar a racematos. No suele ser de interés sintético, pues si nos interesa un solo enantiómero tendríamos que descartar la mitad de los productos obtenidos.

Características[editar]
Las moléculas que contienen un estereocentro (carbono asimétrico, centro esterogénico o centro quiral) siempre son ópticamente activas (quirales). Aunque esto no es cierto necesariamente para algunas moléculas con más de un estereocentro. Este es el caso de las formas meso. Los enantiómeros tienen las mismas propiedades químicas y físicas, a excepción de su respuesta ante la luz polarizada (actividad óptica). Por ello se los denomina isómeros ópticos.
Las moléculas aquirales, sin estereocentros, son ópticamente inactivas.
La rotación específica de la luz polarizada, que se mide por medio de un polarímetro, es una propiedad física característica de la estructura de cada enantiómero, de su concentración y del disolvente empleado en la medición.
La medida de la rotación específica indica la composición enantiomérica del producto.
Representación[editar]

Por comodidad, los enantiómeros se suelen representar mediante la proyección de Fischer. Ésta consiste en imaginar que se observa la molécula de tal manera que dos de los enlaces (representados horizontalmente) están hacia adelante y los otros dos (representados verticalmente) hacia atrás. De esta forma se constituye una especie de cruz, con el carbono asimétrico en el centro, mostrándose como la intersección de las líneas. Los grupos que se encuentren en la línea horizontal (X, Z) están hacia delante, y los verticales (W, Y) en la parte de atrás.
Nomenclaturas[editar]
Formas dextro y levo[editar]
Un enantiómero que rota el plano de la luz polarizada hacia la derecha (en el sentido de las agujas del reloj), se dice que es dextrorrotatorio, dextrógiro o una forma dextro, y suele colocársele al nombre de este una letra "de" minúscula (d), o un signo positivo (+). Si lo hace hacia la izquierda, es levorrotatorio, levógiro o una forma levo, y suele colocársele como prefijo al nombre una letra "ele" minúscula (l), o un signo negativo (–[5]). La única forma de saber si es el enantiómero l o el d es experimentalmente.
Nomenclatura D-L[editar]
Se parte de la proyección de Fischer: se proyecta la molécula sobre el plano del papel con las siguientes condiciones:
- La cadena carbonada se sitúa en vertical, con los grupos que la integran en dirección a la parte posterior del plano.
- La cadena se orienta con la parte más oxidada hacia arriba y la más reducida hacia abajo.
- Los sustituyentes que no integran la cadena carbonada quedan horizontales y están dirigidos hacia la parte anterior del plano.[6]
Cuando se aplica este convenio, llamamos isómero D al que presenta el grupo funcional a la derecha desde el punto de vista del observador, y llamamos isómero L al que lo tiene hacia la izquierda.
- en las pentosas y hexosas, se considera grupo funcional al grupo OH del penúltimo carbono (por ser el carbono asimétrico más alejado del grupo aldehído o cetona)
- en los aminoácidos se considera grupo funcional al grupo amino (NH2) del segundo carbono (carbono a, también llamado carbono α)
Nomenclatura R-S[editar]

Una forma no experimental para nombrarlos es la que sigue las reglas de Prelog-Ingold-Cahn: Consiste en numerar a los grupos o átomos enlazados al carbono asimétrico, de acuerdo a su prioridad (el número 1 al más importante y el 4 al de menor importancia), si según el orden de las manecillas del reloj (sin contar al de menor importancia) este sigue su misma dirección se coloca una erre mayúscula (R), mientras que si es en sentido contrario a las agujas del reloj una ese minúscula (s). En el caso de que el grupo o átomo con menor prioridad se encuentre adelante según la proyección de Fisher (en la horizontal), se considera que se está viendo desde atrás de la molécula, por lo que se considera al revés. En otras palabras si según Prelog-Ingold-Cahn, es R se debe considerar como S. En el caso en que exista más de un carbono asimétrico debe colocarse junto a la letra R o S, el número del carbono correspondiente.
La prioridad del átomo es definida en primera instancia por su número atómico o peso atómico en orden creciente (normalmente el de menor prioridad resulta ser un hidrógeno), y en segunda instancia por el número atómico de los átomos a los que está enlazado, considerando dobles enlaces como si estuviera unido a dos de esos átomos y de manera análoga los triples enlaces como si estuviera unido a tres de esos átomos. No existe ninguna relación entre si resulta ser el enantiómero R o S o si el plano de luz polarizada es desviada a la izquierda o a la derecha. Existen indistintamente enantiómeros R que desvían a la izquierda o a la derecha y con el S lo mismo. La razón es que Levo o Dextro se determina experimentalmente y la R y S es un criterio con normas teóricas impuestas artificialmente.
Separación de enantiómeros[editar]
La separación de enantiómeros presentes en una mezcla racémica se denomina resolución. Los métodos de resolución más utilizados son:
- La resolución química consiste en la separación de los enantioméros mediante la conversión de la mezcla racémica en una mezcla de diastereoisómeros. Para ello, la mezcla de enantiómeros se hace reaccionar con un compuesto quiral, denominado agente de resolución, de modo que los enantiómeros se transforman en diasteroisómeros, los cuales se pueden separar mediante destilación, cristalización o cromatografía. Una vez separados, se procede a la eliminación del agente de resolución para obtener cada uno de los enantiómeros puros.
- La resolución cromatográfica se basa en la utilización de técnicas de cromatografía empleando como fase estacionaria un compuesto quiral. La separación se sustenta en la diferente interacción de ambos enantiómeros con la fase estacionaria quiral. El enantiómero que forma complejos más estables con la fase estacionaria quiral se mueve más lentamente que el enantiómero que forma complejos menos estables; como resultado, eluyen a diferentes velocidades y se separan a lo largo de la columna.
Véase también[editar]
Referencias[editar]
- ↑ IUPAC Gold Book. Compendium of Chemical Terminology. 2a. ed. (1997). Versión en línea: (2006-) "enantiomer"
- ↑ IUPAC Gold Book. Compendium of Chemical Terminology, 2ª ed. (1997). Versión en línea: (2006-) "enantiomerically pure (enantiopure)"
- ↑ Medicamentos: Un viaje a lo largo de la evolución histórica del descubrimiento de fármacos Volumen 2. Enrique Raviña Rubira, Editorial de la Universidad de Santiago de Compostela, 2008. ISBN 8498870089. Pág. 816
- ↑ Química farmacéutica. En: Remington Farmacia. The Science and Practice of Pharmacy. Volumen 1. Alfonso R. Gennaro, Ed. Médica Panamericana, 2003. ISBN 9500618664. Pág. 532
- ↑ Tratado de Química Orgánica: Tomo 1 (1ª parte). Química Orgánica sistemática. F. Klages. Editorial Reverté, 1968. ISBN 8429173145. Pág. 21
- ↑ Nomenclatura D-L. Curso de biomoléculas. Juan Manuel González Mañas. Universidad del País Vasco.

![{\displaystyle {\left[\alpha \right]}_{D}^{25^{\circ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d38060bd8c58c32cb4bf04d93affd485f48a67f)



