Declive en las poblaciones de anfibios

Desde el año 1980 se ha registrado un dramático declive en las poblaciones de anfibios de todo el mundo,[1][2][3][4] caracterizado por colapsos en las poblaciones y extinciones masivas localizadas.
En el año 1993 las poblaciones de más de 500 especies de ranas y salamandras de los cinco continentes presentaban un declive en su población.[5] El declive anfibio está afectando a miles de especies en todo tipo de ecosistemas, por lo que se ha catalogado como una de las amenazas más críticas a la biodiversidad global.[6]
Los declives y las extinciones masivas en las poblaciones de anfibios son un problema global con causas locales complejas. Entre las causas podemos encontrar: incrementos en los índices de radiación ultravioleta (consecuencia de la debilitación de la capa de ozono atmosférico), nuevos depredadores en los ecosistemas actuales (especies introducidas), fragmentación y destrucción de hábitat, toxicidad y acidez ambiental, enfermedades emergentes, cambios climáticos, e interacciones entre estos factores.
Inicialmente, los reportes sobre el dramático declive anfibio no fueron tomados en cuenta por toda la comunidad científica, algunos científicos argumentaban que las poblaciones de animales, como las de los anfibios, varían con el tiempo. Hoy se ha consensuado que han ocurrido alarmantes declives en las poblaciones de anfibios de todo el globo,[7][8][9][10][11][12] y se espera que los declives continúen aumentado.[13]
Dado que los anfibios tienen generalmente un ciclo de vida de dos fases, el larvario (acuático) y el adulto (terrestre), son sensibles a cambios producidos en cualquiera de los dos ambientes. Debido a este aspecto y al hecho de que su piel es altamente permeable, se piensa que los anfibios pueden ser más susceptibles a las toxinas del ambiente, o a los cambios en los patrones de temperatura, lluvias o humedad, que otras especies de vertebrados terrestres.[7][14] Los científicos se están empezando a referir a los anfibios como canarios en una mina de carbón, para hacer referencia a un indicador de la contaminación generada por la actividad humana, y que probablemente pronto empiecen a verse afectadas otras especies de animales.
Antecedentes
[editar]Los anfibios conforman un grupo de organismos vertebrados con alrededor de 6000 especies conocidas, que incluye ranas, sapos, salamandras o tritones y ápodos o cecilias, que existe desde hace aproximadamente 300 millones de años, y solo entre los años 1970 y 2000 se cree que alrededor de 168 especies se han extinguido, y por lo menos 2469 especies (el 43 %) presentan un declive en su población, indicando que probablemente el número de especies amenazadas continúe incrementándose.[13]
Una convención internacional de biólogos celebrada en el año 2004 indicó que el 32 % de las poblaciones anfibias de todo el mundo están en riesgo de extinción (representando 1856 especies), y más de 120 especies ya se han extinguido desde el año 1980.[13]
Los declives han sido particularmente intensos en el oeste de los Estados Unidos, América Central, América del Sur, y el este de Australia (sin embargo, casos de extinciones masivas de anfibios han aparecido por todo el mundo). Mientras que las actividades humanas están causando una gran pérdida en la biodiversidad a nivel global, al parecer los anfibios están sufriendo un efecto mucho mayor que el registrado en otras especies de organismos.
Los declives en la población de anfibios fueron ampliamente reconocidos por primera vez a finales de 1980, cuando una asamblea de herpetólogos reportó haber detectado descensos en las poblaciones a lo largo del globo.[14] Entre estos declives, se encuentra el sapo dorado de Monteverde, Costa Rica, una especie que se consideraba común. El sapo dorado, Bufo periglenes, era tema de investigación científica por esos años, hasta que en 1987 su población se redujo significativamente de forma repentina, desapareciendo completamente en 1989.[15] Otras especies de Monteverde, incluyendo la rana arlequín de Monteverde, Atelopus varius, desaparecieron al mismo tiempo. Debido a que estas especies estaban localizadas en una reserva natural protegida, donde su extinción no podía relacionarse con la actividad humana, el suceso despertó una especial preocupación entre los científicos.
¿Fluctuaciones naturales o declive problemático?
[editar]A finales de 1980, cuando el declive de las poblaciones anfibias fue presentado como un tema concerniente a la conservación de especies, algunos científicos se mostraron incrédulos ante la realidad y gravedad que presenta la problemática de conservación de estas especies.[16] Algunos biólogos argumentaron que el tamaño de las poblaciones de la mayoría de los organismos, anfibios incluidos, tiende a variar por causas naturales. Ellos argumentaban que la falta de información a largo plazo sobre las poblaciones de anfibios hacían difícil determinar si los declives reportados por los biólogos eran dignos de los recursos y esfuerzos del programa de conservación.
Sin embargo, desde este escepticismo inicial, los biólogos han llegado a consensuar que los declives en la población anfibia son una amenaza real para la biodiversidad.[13] Este consenso surgió con el incremento del número de estudios que monitorizaban las poblaciones de anfibios y la observación directa de la mortalidad masiva en lugares que carecían de causas aparentes, y el conocimiento de que los declives en la población de anfibios son verdaderos a nivel global.[17]
Potenciales causas del declive
[editar]Existen muchas hipótesis sobre el reciente declive anfibio, por lo general separadas en dos grupos principales basados en la investigación de Collins y Storfer:[18] El primer grupo incluye factores generales de la crisis de biodiversidad: Destrucción, modificación y fragmentación del hábitat, especies introducidas y sobre explotación. Para estas amenazas, tenemos una mejor comprensión de las declinaciones de anfibios subyacentes de los mecanismos ecológicos. Sin embargo, las poblaciones de anfibios han sufrido declives en ambientes naturales remotos sin perturbaciones aparentes. El segundo grupo de factores, más complejos y elusivos, que potencialmente estén vinculados con el declive, son: cambio climático, incremento en la radiación UV-B, contaminantes químicos, enfermedades infecciosas emergentes, y deformidades o malformaciones. Los mecanismos subyacentes a estos factores son complejos y pueden estar trabajando sinérgicamente con los factores del primer grupo, tales como la destrucción del hábitat y las especies introducidas, exacerbando los descensos.
Los investigadores están encontrando que no hay una sola causa que encierre el declive global, todos los factores antedichos están amenazando a poblaciones anfibias en mayor o menor grado. Muchas de las causas del declive anfibio son bien comprendidas y explicadas, y parecen afectar a otros grupos de organismos además de los anfibios.
Destrucción y fragmentación del hábitat
[editar]
- Modificación del hábitat
La modificación o destrucción del hábitat es, claramente, el factor más dramático que afecta a las poblaciones de anfibios alrededor del mundo. Debido a que los anfibios generalmente necesitan de los hábitats tanto terrestres como acuáticos para sobrevivir, la amenaza a cualquiera de los dos hábitats puede afectar su población, por lo tanto, los anfibios pueden ser más vulnerables a la modificación del hábitat que los organismos que requieran solamente un tipo del hábitat.[19][20]
La evolución en las técnicas de cultivo y uso del suelo ha incidido muy seriamente en la población de los anfibios. Es el caso de la comunidad valenciana (España), donde se ha visto un incremento progresivo de la superficie bajo riego, con el incremento de la población de anfibios y, en las últimas décadas del siglo XX, una disminución catastrófica de dicha población, debido a la sustitución de los canales y acequias de riego (para el riego por inundación) por el riego por goteo. Las ventajas del riego por goteo son obvias para la agricultura: permite un uso más eficiente del agua (que puede así destinarse a otros usos no agrícolas) y un aumento del rendimiento; pero evidentemente contribuye a la disminución de las poblaciones de anfibios y posiblemente su eventual desaparición. Así, durante la posguerra era muy frecuente que los agricultores valencianos comieran las ancas de las ranas recogidas en las acequias de riego. Pero al modificar el sistema de riego (al riego por goteo) las ranas, evidentemente, han desaparecido.
- Fragmentación del hábitat
La fragmentación de un hábitat tiene lugar cuando se establecen barreras físicas que separan el espacio original en porciones o fragmentos más pequeños. Por ejemplo, cuando una pequeña área de bosque es rodeada por terrenos agrícolas, dividiendo el espacio original en dos fragmentos de tamaño reducido, que dificulta el libre movimiento y el intercambio genético entre las poblaciones de seres vivos antes próximas. Las pequeñas poblaciones que sobreviven dentro de estos hábitats fragmentados son a menudo susceptibles a procesos de endogamia, deriva genética, o extinción debido a pequeñas fluctuaciones en el medio ambiente.
Especies introducidas
[editar]
Los depredadores y competidores no nativos están afectando a la viabilidad de las ranas y de otros anfibios en sus hábitats naturales. Se ha detectado un declive en la población de la rana de montaña de patas amarillas que típicamente habita los lagos de Sierra Nevada (EE. UU.) debido al aumento de peces no nativos (truchas) criados o sembrados para la pesca recreativa. Grandes números de ranas en desarrollo y los renacuajos mismos, caen presa de estos peces. Esta interferencia en el ciclo de tres años de metamorfosis de las ranas está causando una declinación en la población que queda de manifiesto a través de su ecosistema.[21]
Sobreexplotación
[editar]Los anfibios son extraídos de sus hábitat naturales y vendidos internacionalmente como alimento, como animales domésticos, o para suministro de mercados medicinales y biológicos.
- Anfibios como alimento

La forma primaria de uso de los anfibios como alimento son las patas de rana. Las patas de rana son extremadamente populares en Europa, Canadá y los Estados Unidos. Durante 1990, Europa importó 6000 toneladas de patas de rana por año. Entre 1981 y 1984, los Estados Unidos importaron más de 3 millones de kilogramos de carne de rana por año. Esto es aproximadamente el equivalente a 26 millones de ranas.[22]
Asia es el segundo mayor mercado en consumo de ranas a nivel mundial, donde la especie mayormente consumida es la rana comestible china (Hoplobatrachus rugulosus).[22] En solo un año, más de 6 millones de Hoplobatrachus rugulosus fueron importados a Hong Kong desde Tailandia. Se presume que todas estas ranas están siendo recolectadas de sus ambientes naturales; dado el número de ranas recolectadas, de continuar esta práctica las poblaciones salvajes restantes de esta especie podrían desaparecer en poco tiempo.[23]
Otra especie sobreexplotada para satisfacer el mercado alimentario es la rana de patas rojas (Rana draytonii), que habita en Estados Unidos, al oeste de California. Las ranas de patas rojas californianas, se encuentran actualmente bajo protección federal, señaladas como especie amenazada, y ya no son cosechadas, pero sus poblaciones permanecen en peligro dada la competencia generada por otras especies introducidas.[22]
- Anfibios como mascotas


Los anfibios siempre han sido mascotas populares. Niños de todas las edades juntan renacuajos de charcos y lagunas cercanas para criarlos en sus hogares y observar el proceso metamórfico por el que estos se convierte en ranas o sapos. Sin embargo, la captura de anfibios ha crecido en popularidad en los últimos años, y ya no se trata solamente de niños. Muchos anfibios son puestos a la venta por sus colores brillantes y llamativos. Una de las víctimas de esta práctica es la rana Goliat, Conraua goliath, la rana más grande del mundo, localizada exclusivamente en algunos ríos de Camerún y Guinea Ecuatorial.
- Anfibios en la educación y la investigación
La mayoría de la escuelas estadounidenses incorporan a sus currículos clases de disección de anfibios en sus materias de estudio e introducción a la biología. El bajo costo y la disponibilidad de las ranas hacen de ellas candidatos ideales para esto. Las especies más comúnmente utilizadas con este fin son las ranas leopardo (Rana pipiens) y la rana toro americana (Rana catesbeiana). Además de las ranas, los mudpupies (Necturus maculosus) son frecuentemente usados en los laboratorios de las facultades de biología.
- Anfibios en la medicina
Es difícil determinar si el uso de los anfibios en la medicina está teniendo un efecto adverso en sus poblaciones naturales. Por el contrario, el reciente interés suscitado por el descubrimiento y estudio de la variedad de compuestos producidos por los anfibios a causa de sus propiedades farmacológicas pueden tener efectos beneficiosos en la conservación.
Las culturas asiáticas consideran extremadamente importantes a los anfibios para su uso medicinal. Se cree que muchas partes de ciertos anfibios tienen propiedades curativas y afrodisíacas. Dos ejemplos comunes de anfibios vendidos para las compañías médicas chinas y droguerías son los oviductos disecados de la Rana chensinensis y la piel de algunos sapos.[22]
Muchos sapos del género Bufo producen una toxina llamada bufotenina que tiene propiedades alucinógenas. Otras toxinas como la 5-MeO-DMT, es producida por Bufo alvarius. A causa de esto, los sapos son recolectados en busca de estas toxinas. La extracción de las toxinas no necesita matar a los sapos, pero es seguro que el proceso de recolección está afectando sus poblaciones negativamente.
Contaminantes químicos
[editar]Existe una clara evidencia de que los agentes contaminantes químicos están causando el desarrollo de deformidades en las ranas (miembros extra, ojos mal formados, etc). Los agentes contaminantes tienen efectos variables en las ranas. Algunos alteran el sistema nervioso central, otros como la atrazina causan una disrupción en la producción y secreción de hormonas. Estudios experimentales han demostrado que la exposición a ciertos herbicidas como el Roundup de Monsanto o insecticidas como el malathion o carbaryl tienen un alto incremento en la mortandad de renacuajos.[24] Otros estudios adicionales indican que en las etapas terrestres de los anfibios adultos, estos son también susceptibles al Roundup, particularmente al POEA, que es en sí mismo un tensoactivo[25] y no un pesticida.
Mientras que la mayoría de los efectos de los pesticidas son por lo general locales y restringidos a las áreas cercanas a las zonas de agricultura, existe evidencia obtenida de las montañas de Sierra Nevada al oeste de los Estados Unidos, de que los pesticidas pueden viajar grandes distancias hasta zonas vírgenes, como por ejemplo el parque nacional de Yosemite en California. Algunas de las evidencias señalan al ozono como posible factor contribuyente al declive mundial en las poblaciones de anfibios.[26]
Enfermedades
[editar]
Un número de enfermedades han sido relacionadas con las muertes masivas, o el declive en las poblaciones de anfibios, como la enfermedad de la pata roja (Aeromonas hydrophila), Ranavirus (Iridiviridae), Anuraperkinsus, y quitridiomicosis. Todavía no queda claro porque estas enfermedades comenzaron a afectar repentinamente a las poblaciones de anfibios, pero existe algo de evidencia que sugiere que estas enfermedades han sido diseminadas por los humanos, o pueden volverse más virulentas cuando se combinan con otros factores ambientales.
- Trematodos
Hay suficiente evidencia sobre la contribución en el desarrollo de anormalidades y declives en poblaciones de anfibios por parte de los parásitos denominados Trematodas platyhelminths.[27] Estas trematodas del género Ribeiroia tiene un complejo ciclo de vida, con tres especies huésped. El primer huésped incluye un número de especies acuáticas de caracoles. Las trematodas en sus etapas larvarias iniciales se transmiten a los renacuajos, donde la Metacercarias se enquistan generando brotes en los miembros. Estos ciclos de vida, desarrollan anormalidades en ranas post-metamórficas, incluyendo pérdida o miembros extras.[13] Estas anormalidades o malformaciones incrementan la depredación de las ranas por las aves acuáticas, el huésped final de la trematoda.
- Quitridiomicosis
En 1998, siguiendo las muertes de ranas a gran escala en los equipos de investigación en Australia y América Central, llegaron a resultados idénticos: una especie de hongo patógeno sin descripción previa Batrachochytrium dendrobatidis. Hoy se sabe que muchas de las extinciones de anfibios en Australia y las Américas están ligadas con este hongo, el cual pertenece a una familia de saprobes conocida como chytrids que por lo general no son patógenas.
Esta enfermedad causada por Batrachochytrium dendrobatidis es llamada quitridiomicosis. Las ranas infectadas con esta enfermedad generalmente muestran lesiones en la piel e hiperqueratosis, y se cree que la muerte es causada porque el hongo hace imposible que los anfibios puedan respirar a través de la piel. El tiempo desde la infección hasta la muerte se ha calculado en 1 o 2 semanas en pruebas experimentales.
Investigaciones subsecuentes han establecido que el hongo ha estado presente en Australia desde por lo menos 1978, y en Norteamérica por lo menos desde 1970. El primer registro conocido de la infección chytrica en ranas fue en la rana africana Xenopus laevis. Debido a que los Xenopus son vendidos en tiendas de mascotas y utilizados en laboratorios de todo el mundo, es posible que el hongo cytrido haya sido importado de África a las Américas.
- Aeromonas hydrophila
El patógeno bacteriano Aeromonas hydrophila fue aislado en la rana de montaña de patas amarillas, Rana muscosa, en el parque nacional Cañón de los Reyes (California, EE. UU.), y se cree que es el responsable de las muertes masivas en 1979,[28] así como también de las muertes del sapo boreal, Bufo boreas.[29]
Cambio climático
[editar]
Una gran cantidad de ecosistemas están siendo destruidos a un ritmo fenomenal, disminuyendo la disponibilidad de hábitats. Los agentes contaminantes afectan indirectamente a las ranas y otros anfibios por la disminución de la capa de ozono, causando que la radiación solar dañe sus delicadas y húmedas pieles, y afectando su sistema inmune.[30] La permeabilidad de la piel de los anfibios, sus ciclos de vida bifásicos y sus huevos sin cáscara protectora, vuelven a los anfibios extremadamente susceptibles a pequeños cambios en la temperatura y niveles de humedad.[31]
Los mecanismos inherentes a las hipótesis de cambio climático presentan mayor dificultad y complejidad en su entendimiento. El cambio global puede afectar a una región directamente o desencadenar una serie de eventos que tengan efecto en una región alejada del foco del cambio.[32] Las hipótesis de cambio global son intrínsecamente complejas, impactando individuos y poblaciones directa o indirectamente, y puede tomar años o décadas para ponerse de manifiesto[33] Algunos de los efectos del calentamiento global parecen ser la crianza o reproducción prematura por parte de algunas especies de anfibios de climas templados,[34] que dejan a estas especies susceptibles a los efectos climáticos que acontecen en estaciones donde dichas especies deberían estar invernando.
Una serie de estudios en los trópicos han encontrado una relación causal entre irregularidades climáticas y declives poblacionales. En Brasil, se ha registrado la extinción de cinco especies de sapos en consecuencia a una serie de heladas.[35] También en Brasil, se han detectados declives en poblaciones de anfibios relacionados con inviernos más secos.[36] En Puerto Rico, se han relacionado los dramáticos declives en la población de coqui puertorriqueño, Eleutherodactylus coqui, se correspondían con el creciente número de extensos periodos secos (baja cantidad de precipitaciones, menos de 3mm).[37] Es también el caso de la extinción de sapo dorado de Monteverde, Bufo periglenes, y el declive de otras especies de ranas de la zona, que ha sido asociada con una frecuencia irregular en el índice de humedad de la neblina de los bosques tropicales de Monteverde.[38]
Otros estudios han encontrado que en días extremadamente secos, se reduce la profundidad de los charcos donde algunas especies de anfibios dejan sus huevos. La disminución de la profundidad incrementa la exposición de los embriones de anfibios a una mayor dosis de radiación UV-B, incrementando la susceptibilidad a enfermedades infecciosas como la Saprolegnia ferax, que causa la mortandad de los huevos.[39][40][41]
Radiación UV-B
[editar]Los niveles de la radiación UV-B en la atmósfera han aumentado significativamente en las últimas décadas. Los investigadores han encontrado que la radiación UV-B puede matar a los anfibios directamente, causar efectos secundarios, tales como tasas de crecimiento retardadas, disfunción inmune y trabajar en conjunto con los contaminantes, los patógenos y el cambio climático, potenciando su declive.
Existen tres tipos de radiación ultravioleta: UV-A (315-400nm), UV-B (280-315 nm) y UV-C (200-280 nm). La mayoría de las biomoléculas no absorben las longitudes de onda correspondientes a la radiación UV-A y la mayoría de la radiación UV-C es absorbida por el ozono estratosférico, sin embargo, la radiación UV-B es particularmente dañina para los organismos vivientes.
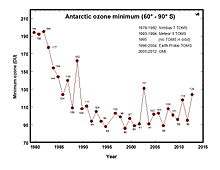
Se ha detectado un notable incremento de la radiación UV-B debido al cambio climático y la reducción del ozono estratosférico. Los anfibios son extremadamente susceptibles a la radiación UV-B, dado que sus huevos carecen de coraza o carcasa, y sus pieles, tanto de los especímenes adultos y de los renacuajos son delgadas y delicadas. Es altamente probable que los incrementos en la radiación UV-B hayan contribuido significativamente al declive anfibio.[42] Investigaciones en más de diez especies de anfibios han encontrado una enzima que se la encargada de las reparaciones por daños al ADN anfibios frente a la radiación UV. Experimentos de laboratorio en huevos de salamandra Ambystoma gracile muestran una clara evidencia de que estos son susceptibles a la radiación UV-B.[43] Es probable que las especies anfibias con mayor actividad enzimática (fotoliasas), puedan reparar el daño inducido en el ADN por radiación UV, más eficientemente que otras especies con menor actividad enzimática de este tipo.[40]
Deformidades y malformaciones
[editar]Ha habido un aumento reciente y una ocurrencia extensa de deformidades (o de malformaciones) en las poblaciones naturales de anfibios, y se ha clasificado recientemente como un problema ambiental relevante.[44]
En el verano de 1995, un reporte por parte de un profesor de una escuela en Le Sueur (Minnesota), sobre raras deformidades en ranas leopardo, llevó a una investigación de la Agencia de control de polución de Minnesota en la que se descubrió que el 30-40 % de las ranas del lugar presentaban malformaciones. Posteriormente, los biólogos descubrieron que las deformidades no solo tenían lugar en Minnesota, sino en todo el mundo en grandes números.
Ha habido grandes debates acerca de qué causa las deformidades de los anfibios en sus ambientes naturales, y se ha demostrado que es algo difícil de determinar. Es muy fácil inducir deformidades en embriones criados en laboratorios, pero estas no siempre concuerdan con las observadas en los hábitats de los anfibios en cuestión.[45] También es difícil de determinar si los índices de deformaciones en las poblaciones se han incrementado en los últimos años, o si el incremento de reportes se debe a una mayor atención por parte de los medios.[46]
A pesar de esta falta de certidumbre, una cosa es bastante clara, y es que la deformidades, así como también el declive anfibio en general, son probablemente el resultado de múltiples causas, todas relacionadas con los daños producidos por las actividades humanas en el medio ambiente[47] La hipótesis original explica que el incremento de deformidades en los anfibios es causa del incremento en los niveles de radiación ultravioleta (UV), los contaminantes químicos, y las infecciones parasitarias.
Estrategias de conservación
[editar]
Global Amphibian Assessment ha creado un plan de acción para la conservación de los anfibios.[48][49] El plan de conservación se resume en cuatro puntos que deben ser llevados a cabo inmediatamente:
- Mejorar el entendimiento de las causas de los declives y las extinciones.
- Documentar la diversidad anfibia y como está cambiando.
- Desarrollo e implementación de programas de conservación a lago plazo.
- Respuesta de emergencia a las crisis inmediatas.
Estas son algunas de las formas para revertir, aminorar o prevenir los declives en las poblaciones de anfibios:
- Protección de hábitat: La pérdida y degradación de hábitat está afectando al 90 % de las especies de anfibios amenazadas. La mayoría de estos, requieren conservación de hábitat para asegurar su supervivencia. Por lo tanto, salvaguardando los sitios clave de los anfibios amenazados es la prioridad más urgente para la supervivencia de muchas especies.
- Crianza en cautiverio: Los programas de crianza en cautiverio para especies amenazadas se está llevando a cabo en parques zoológicos. Las especies criadas podrán ser utilizadas en posteriores reintroducciones a su medio ambiente natural.
- Reintroducción: Programas de reintroducción de especies de anfibios nuevamente dentro de sus hábitats naturales con la esperanza de que nuevas poblaciones puedan ser establecidas. El objetivo de la reintroducción es la de restablecer, poblaciones protegidas y viables de anfibios en su medio ambiente natural, donde solamente la disminución de la amenaza de estos es poco probable que de lugar a la recuperación de sus poblaciones.
- Remoción de especies introducidas: La remoción de especies introducidas se está llevando a cabo en lugares donde estas amenazan a las especies nativas, obteniendo así la sustentación y paulatina recuperación de las poblaciones de anfibios en la zona.
Proyecto Amphibian Ark
[editar]El 16 de febrero de 2007, científicos de todo el mundo se reunieron en Atlanta, Estados Unidos, para dar inicio a un grupo llamado The Amphibian Ark, para salvar a más de 6000 especies de anfibios de la extinción del hongo causante de la quitridiomicosis.[50]
Estado actual de las poblaciones de anfibios
[editar]
Con los datos recogidos por Global Amphibian Assessment hasta principios del año 2006 se estima que:
- Alrededor de un tercio (32 %) de las especies de anfibios se encuentran en peligro de extinción, representando unas 1896 especies. En comparación, solo el 12 % de todas las especies de aves y un 23 % de todas las especies de mamíferos están amenazadas.
- Más de 165 especies de anfibios pueden estar extintas. Se sabe que por lo menos unas 34 especies de anfibios se encuentran extintas, una especie se encuentra extinta en la naturaleza, y al menos otras 130 especies no ha sido vistas en los últimos años y posiblemente se encuentren extintas.
- Por lo menos un 43 % de todas las especies de anfibios presentan un continuo declive en sus poblaciones, indicando que el número de especies amenazadas probablemente aumente en el futuro. En contraste, menos del 1 % de las especies presentan incrementos en sus poblaciones.
- El mayor número de especies amenazadas tiene lugar en los países de América Latina, como Colombia (209), México (198), y Ecuador (163). Sin embargo, los niveles más altos de especies amenazadas se encuentran en el Caribe, donde más del 80 % de los anfibios se encuentran en peligro de extinción en la República Dominicana, Cuba, y Jamaica, alcanzando un pico de 92 % en Haití.
- Aunque claramente, la pérdida de hábitat es la mayor amenaza para los anfibios, una reciente enfermedad detectada, causada por los fumigadores, está afectando seriamente a un creciente número de especies. Tal vez más perturbador, es el hecho de que muchas especies están de declive por razones desconocidas, complicando los esfuerzos de diseñar e implementar estrategias efectivas para la conservación.
Notas y referencias
[editar]- ↑ Conservation International Press Release - Anfibios en Dramático Declive.
- ↑ eco2site Archivado el 20 de diciembre de 2008 en Wayback Machine. Catastrófico declive de anfibios advierte significativa degradación ambiental.
- ↑ FrogWatch USA Archivado el 1 de diciembre de 2008 en Wayback Machine. Amphibian Decline: Frogs still in a fix.
- ↑ *Howstuffworks Are frogs on the brink of extinction?
- ↑ Vial J. L., Saylor, L. 1993. The Status of Amphibian Populations: a Compilation and Analisis. IUCN/SSC Declining Amphibian Taskforce. Work. Doc. No. 1.
- ↑ Alford, Ross A., Stephen J. Richards. 1999. «Global Amphibian Declines: A Problem in applied ecology.» Anual Review of Ecology and Systematics, Vol. 30. (1999), pp. 133-165.
- ↑ a b Vitt, L. J., Caldwell, J. P., Wilbur, H. M., Smith, D. C. 1990. «Amphibians as harbingers of decay.» BioScience 40:418-18
- ↑ Pechmann, J. H. K., Wake, D. B. 1997. «Declines and disappearances of amphibian populations.» En Principles of Conservation Biology. Coordinadores; Meffe, G. K. & C. R. Carroll, pp. 135-37. Sunderland, MA: Sinauer. 2nd ed.
- ↑ Blaustein, A. R., Wake, D. B., Sousa, W. P. 1994. «Amphibian declines: judging stability, persistence, and suceptibility of populations to local and global extinctions.» Conserv. Biol. 8:60-71.
- ↑ Corn, P. S. 1994. «What we know and don't know about amphibian declines in the west.» En Sustainable Ecological Systems: Implementing an Ecological Approach to Land Management. Coordinadores: DeBano, L. F. & W. W. Covington, pp. 59-67. Fort Collins, CO:USDA For. Serv. Rocky Mountain For. Range Exp. Station.
- ↑ Kuzmin, S. 1994. «The problem of declining amphibian populations in the Commonwealth of Independent States and adjacent territories.» Alytes 12:123-34
- ↑ Waldman, B., Tocher, M. 1998. «Behavioral ecology. generic diversity, and declining amphibian populations.» En Behavioural Ecology and Conservation Biology. Coordinador: T. Caro, pp. 394-443. New York: Oxford Univ. Press.
- ↑ a b c d e Stuart, S. N., J. S. Chanson, N. A. Cox, B. E. Young, A. S. L. Rodrigues, D. L. Fischman y R. W. Waller. 2004. «Status and trends of amphibian declines and extinctions worldwide.» Science 306:1783-1786.
- ↑ a b Blaustein, A. R. & D. B. Wake. 1990. «Declining amphibian populations: a global phenomenon?» Trends in Ecology and Evolution 5:203-204.
- ↑ Crump, M. L., F. R. Hensley y K. I. Clark. 1992. «Apparent decline of the golden toad: Underground or extinct?» Copeia 1992:413-420.
- ↑ Pechmann, J.H.K., D.E. Scott, R.D. Semlitsch, J.P. Caldwell, L.J. Vitt, and J.W. Gibbons. 1991. Declining amphibian populations: the problem of separating human impacts from natural fluctuations. Science 253:892-895.
- ↑ Houlahan, J.E., C.S. Findlay, B.R. Schmidt, A.H. Meyer, and S.L. Kuzmin. 2000. Quantitative evidence for global amphibian population declines. Nature 404:752-758.
- ↑ Collins, J. P., and A. Storfer. 2003. Global amphibian declines: Sorting the hypotheses. Diversity & Distributions [print] 9:89-98.
- ↑ Green DM. 1997. Perspectives on amphibian population declines: defining the problem and searching for answers. In Amphibians in Decline. Canadian Studies of a Global Problem, ed. DM Green, pp. 291-308. Herpetological Conserv., Vol 1.
- ↑ Johnson B. 1992. Habitat loss and declining amphibians populations. See Ref. 22, pp. 71-75
- ↑ [1] "On the Rebound." Elizabeth Daerr, National Parks Magazine, January-February 2005, p. 49]
- ↑ a b c d Jensen, J. B., and C. D. Camp. 2003. Human exploitation of amphibians: direct and indirect impacts. Pages 199-213 in R. D. Semlitsch, editor. Amphibian Conservation. Smithsonian Institution, Washington.
- ↑ Wai-Neng Lau, M., G. Ades, N. Goodyer, and F.-s. Zou. 1999. Wildlife Trade in Southern China including Hong Kong and Macao. in The Biodiversity Working Group: China Council for International Cooperation on Environment and Development, Beijing.
- ↑ Relyea, R.A. 2004. The impact of insecticides and herbicides on the biodiversity and productivity of aquatic communities. Ecological Applications 15(2):618–627.
- ↑ Relyea, R.A. 2005. The lethal impact of Roundup on aquatic and terrestrial amphibians. Ecological Applications 15(4): 1118–1124.
- ↑ Dohm, M.R., et al. 2005. Effects of ozone exposure on nonspecific phagocytic capacity of pulmonary macrophages from an amphibian, Bufo marinus. Environmental Toxicology and Chemistry 24:205-210.
- ↑ Johnson, P.T.J., and J.M. Chase. 2004. Parasites in the food web: linking amphibian malformations and aquatic eutrophication. Ecology Letters 7:521-526.
- ↑ Bradford, D. F. 1991. Mass mortality and extinction in a high elevation population of Rana muscosa. Journal of Herpetology 25:369-377.
- ↑ Carey, C. 1993. Hypothesis concerning the causes of the disappearance of boreal toads from the mountains of Colorado. Conservation Biology 7:355-362.
- ↑ FrogWatch USA Archivado el 23 de febrero de 2007 en Wayback Machine. Amphibian Decline: Changing Climate Equals Decline.
- ↑ Carey, C., and M. A. Alexander. 2003. Climate change and amphibian declines: is there a link? Diversity and Distributions 9:111-121.
- ↑ Stenseth, N.C., Mysterud, A., Otthers, G., Hurrell, J.W., Chan, K.-S. & Lima, M. (2002) Ecological effects of climate fluctuations. Science 297, 1292-1296.>
- ↑ Whalter, G-R., Post, E., Convey, P., Manzel A., Parmesan, C., Beebee, T., Fromentin, J.-M., Hoegh-Guldberg, O. & Bairlein, F. (2002) Ecological responses to recen climate change. Nature 416, 389-395.
- ↑ Beebee, T. J. C. 1995. Amphibian Breeding and Climate. Nature 374:219-220.
- ↑ Heyer, W. R., A. S. Rand, C. A. G. Dacruz, and O. L. Peixoto. 1988. Decimations, Extinctions, and Colonizations of Frog Populations in Southeast Brazil and Their Evolutionary Implications. Biotropica 20:230-235.
- ↑ Weygoldt, P. 1989. Changes in the Composition of Mountain Stream Frog Communities in the Atlantic Mountains of Brazil Frogs as Indicators of Environmental Deteriorations. Studies on Neotropical Fauna & Environment 24:249-256.
- ↑ Stewart, M. M. 1995. Climate Driven Population Fluctuations in Rain-Forest Frogs. Journal of Herpetology 29:437-446.
- ↑ Pounds, J. A., and M. L. Crump. 1994. Amphibian declines and climate disturbance: The case of the golden toad and the harlequin frog. Conservation Biology 8:72-85.
- ↑ Kiesecker, J. M., A. R. Blaustein, and L. K. Belden. 2001. Complex causes of amphibian population declines. Nature 410:681-684.
- ↑ a b Blaustein, A. R., P. D. Hoffman, D. F. Hokit, J. M. Kiesecker, S. C. Walls, and J. B. Hays. 1994. UV repair and resistence to solar UV-B in amphibians eggs: a link to population declines? Procedings of the National Academy of Sciences (USA) 91:1791-1795
- ↑ Hays JB, Blaustein AR, Kiesecker JM, Hoffman PD, Pandelova I, Coyle D, Richardson T. 1996. Developmental responses of amphibians to solar and artificial UVB sources: a comparative study Photochem. Photobiol, 64:449-55.
- ↑ Blaustein, A. R., and D. B. Wake. 1995. The Puzzle of Declining Amphibian Populations. Scientific American 272:52-57.
- ↑ Andrew R. Blaustein, Brian Edmond, Jeseph M. Kiesecker, Joseph J. Beatty, and D. Grant Hokit. Ambient Ultraviolet Radiation Causes Mortality in Salamander Eggs. Ecological Apllications, Vol. 5, No. 3. (Aug., 1995), pp. 740-743.
- ↑ Ouellet, M., J. Bonin, J. Rodrigue, J. L. DesGranges, and S. Lair. 1997. Hindlimb deformities (ectromelia, ectrodactyly) in free-living anurans from agricultural habitats. Journal of Wildlife Diseases 33:95-104.
- ↑ Sessions, S. K. 2003. What is causing deformed amphibians? Pages 168-186 in R. D. Semlitsch, editor. Amphibian Conservation. Smithsonian Institution, Washington.
- ↑ Johnson, P. T. J., K. B. Lunde, D. A. Zelmer, and J. K. Werner. 2003. Limb deformities as an emerging parasitic disease in amphibians: Evidence from museum specimens and resurvey data. Conservation Biology 17:1724-1737.
- ↑ Blaustein, A. R. and P. T. J. Johnson. 2003a. The complexity of deformed amphibians. Frontiers in Ecology and the Environment 1: 87-94.
- ↑ «Amphibian Conservation Action Plan» (pdf) (en inglés). UICN. Archivado desde el original el 7 de abril de 2016. Consultado el 19 de abril de 2006.
- ↑ Conservation International Press Release - Expertos desarrollan un plan de acción global para salvar a los anfibios en peligro de extinción
- ↑ «Ampphibian Arc». amphibianark.org. Consultado el 28 de abril de 2012.
Bibliografía
[editar]- Disappearing Jewels: The Status of New World Amphibians[2]. NatureServe (2004). ISBN 0-9711053-1-6 [3].
- Amphibian Declines: The Conservation Status of United States Specie. University of California Press (2005) ISBN 0-520-23592-4.
- Amphibians in Decline: Canadian Studies of a Global Problem. Society for the Study of Amphibians and Reptiles (1997) ISBN 0-916984-40-0.
- Amphibian Decline: An Integrated Analysis of Multiple Stressor Effects. SETAC Press (2003). ISBN 1-880611-55-4
Véase también
[editar]- Anfibio
- Extinción
- Ecología
- Biodiversidad
- Biología de la Conservación
- Unión Mundial para la Conservación
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre los anfibios.
Wikimedia Commons alberga una categoría multimedia sobre los anfibios. Wikimedia Commons alberga una categoría multimedia sobre conservación de los anfibios.
Wikimedia Commons alberga una categoría multimedia sobre conservación de los anfibios. Wikispecies tiene un artículo sobre los anfibios.
Wikispecies tiene un artículo sobre los anfibios.
- En español
- Museo de Zoología de la universidad Católica de Ecuador Información sobre Declinación de Anfibios en Ecuador.
- Artículo sobre el declive de anfibios en México y la medición práctica de su estado de conservación (artículo académico) en academia.edu
- En inglés
- Global Amphibian Assessment Provee información sobre el estado actual de las especies de anfibios.
- Amphibian Specialist Group The Amphibian Specialist Group strives to conserve biological diversity by stimulating, developing, and executing practical programs to conserve amphibians and their hábitats around the world
- AmphibiaWeb Provee información sobre el declive anfibio.
- FrogWeb Información sobre el declive anfibio y malformaciones.
- Declining Amphibians Popullations Task Force El DAPTF investiga las causas del declive anfibio.
- Amphibian Ark website Implementing the ex situ component of the Amphibian Conservation Action Plan.
- IUCN Redlist websitre Threatened Species Information.
- Partners in Amphibian and Reptile Conservation PARC se dedica a la conservación de los reptiles, anfibios y sus hábitats.
- Frogwatch USA Frog and toad monitoring program for general public.
- BBC News TOP 10 unusual and threatened amphibians.
