Cianuro de potasio
| Cianuro de potasio | ||
|---|---|---|
 | ||
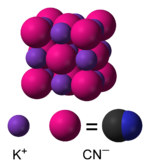 Estructura molecular | ||
| Nombre IUPAC | ||
| Cianuro de potasio | ||
| General | ||
| Otros nombres | Cianuro potásico | |
| Fórmula semidesarrollada | KCN | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 151-50-8[1] | |
| Número RTECS | TS8750000 | |
| ChEBI | 33191 | |
| ChEMBL | CHEMBL2228308 | |
| ChemSpider | 8681 | |
| PubChem | 9032 | |
| UNII | MQD255M2ZO | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco cristalino | |
| Densidad | 1520 kg/m³; 1,52 g/cm³ | |
| Masa molar | 65,12 g/mol | |
| Punto de fusión | 907 K (634 °C) | |
| Punto de ebullición | 1898 K (1625 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | (25 °C) | |
| Peligrosidad | ||
| SGA |
    | |
| NFPA 704 |
0
4
0
| |
| Compuestos relacionados | ||
| Compuestos relacionados |
Cianuro de sodio Azul de Prusia Ácido cianhídrico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cianuro de potasio o KCN es una sal inorgánica denominada sal de potasio del cianuro de hidrógeno o ácido cianhídrico.
Características[editar]
Es altamente soluble en agua, en ácidos y en bases, es insoluble en etanol o metanol y es fatalmente tóxico por ingestión. El KCN tiene un olor característico a almendras amargas,[2] pero no todas las personas pueden percibirlo debido a que la capacidad para ello se encuentra en ciertos rasgos genéticos no demasiado conocidos.[3] Es una de las pocas sustancias que forman compuestos solubles con el oro formando un complejo cianurado, y por esto se usa en joyería para el dorado químico y para dar brillo a este metal.
Puede usarse en la minería del oro para extraer el metal de los minerales, aunque se usa más comúnmente cianuro de sodio. También se utiliza en la galvanoplastia como agente acomplejante de iones metálicos tales como el Zinc, el níquel, el oro y la plata.
Usos[editar]
Es empleado a menudo por entomólogos como agente para matar insectos en los tarros de conservación, ya que la mayoría de los insectos sucumben en segundos, minimizando el daño incluso en las clases más frágiles. El cianuro potásico fue usado por los prisioneros nazis como un medio predilecto y eficiente de suicidio, como fue el caso de Göring y Himmler. Asimismo se empleó en el suicidio masivo de Jonestown.
Reacciones químicas[editar]
1* El cianuro de potasio reacciona con iones metálicos para dar complejos cianurados. Por ejemplo la plata y el níquel:
KCN + Ag+ = [AgCN] + K+. 4Ni + 4KCN → (sólido) NiCN4 + 4K +.
2* Reacciona con ácidos fuertes para generar ácido cianhídrico:
KCN + HCl → HCN (gas)↑ + KCl
Propiedades físicas[editar]
- Punto de ebullición: 1625 °C
- Punto de fusión: 634 °C
- Densidad:
- Estado físico y aspecto: cristales higroscópicos o sólido en diversas formas, de olor característico.
Propiedades químicas[editar]
- Solubilidad en agua: 71,60 g/100 ml a 25 °C
Toxicidad[editar]
El cianuro de potasio es un potente inhibidor de la respiración celular, que actúa sobre la citocromo c oxidasa mitocondrial, bloqueando así la fosforilación oxidativa. La acidosis láctica se produce entonces como consecuencia del metabolismo anaeróbico. Inicialmente, la intoxicación aguda por cianuro provoca una tez roja o rubicunda en la víctima porque los tejidos no pueden utilizar el oxígeno de la sangre. Los efectos del cianuro de potasio y el cianuro de sodio son idénticos, y los síntomas de intoxicación generalmente ocurren a los pocos minutos de ingerir la sustancia: la persona pierde el conocimiento y finalmente sigue la muerte cerebral. Durante este período, la víctima puede sufrir convulsiones. La muerte es causada por hipoxia cerebral. La dosis LD100[nota 1] esperada (humana) para el cianuro de potasio es de 200 a 300 mg, mientras que la LD50[nota 2] se estima en 140 mg.[6]
El KCN se puede desintoxicar de manera más eficiente con peróxido de hidrógeno o con una solución de hipoclorito de sodio. Estas soluciones deberían mantenerse alcalinas siempre que sea posible para eliminar la posibilidad de generación de cianuro de hidrógeno:
- KCN + H2O2 → KOCN + H2O
Notas[editar]
- ↑ La LD100 es la dosis requerida para matar al 100% de los animales de prueba (esto solo se determina en raras ocasiones), mientras que la LD0 es la dosis única más alta teórica que no causa ninguna muerte. Este último valor es difícil de establecer en la práctica, por lo que el LD50 se ha convertido en la referencia estándar de toxicidad aguda.[4]
- ↑ La toxicidad aguda se define como la toxicidad producida por una o más dosis administradas durante un período de 24 horas.[5]
Referencias[editar]
- ↑ Número CAS
- ↑ «Cianuro de hidrógeno y cianuros». Facultad de Química (UNAM). Archivado desde el original el 15 de junio de 2016. Consultado el 27 de mayo de 2015.
- ↑ Victor A. McKusick. «CYANIDE, INABILITY TO SMELL».
- ↑ «LD100» (en inglés). Consultado el 21 de diciembre de 2020.
- ↑ «Acute Toxicity» (en inglés). Consultado el 21 de diciembre de 2020.
- ↑ John Harris Trestrail III. Criminal Poisoning - Investigational Guide for Law Enforcement, Toxicologists, Forensic Scientists, and Attorneys (2nd edition). p. 119
Enlaces externos[editar]
- ATSDR en español - ToxFAQs™: Cianuro: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)
- ATSDR en español - Resumen de Salud Pública: Cianuro: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)



