Cianotoxinas

Las cianotoxinas son toxinas producidas por un grupo de bacterias denominadas cianobacterias (antes denominadas algas verdeazuladas). Estas cianobacterias se encuentran en casi todos los lugares, desde desiertos hasta aguas heladas, pero se desarrollan especialmente en lagos de agua dulce y océanos en los que, bajo ciertas condiciones de eutrofización, se reproducen exponencialmente formando grandes floraciones algales. Estas floraciones de cianobacterias pueden producir cianotoxinas en concentraciones elevadas, siendo perjudiciales para muchos organismos acuáticos, animales domésticos y salvajes y también seres humanos. La intoxicación por las cianotoxinas puede ocurrir ingiriendo las cianobacterias o bien bebiendo el agua contaminada por las toxinas que producen.[1]
Las cianobacterias pueden producir un amplio rango de sustancias químicas poco comunes, varias de ellas únicas de este filo, que se utilizan en la industria alimentaria, la cosmética, la agricultura y la energía. Sin embargo, Especies y cepas de al menos veinte géneros de cianobacterias producen tóxicos potentes que dañan órganos y afectan la función de varios sistemas biológicos. Las cianotoxinas que han provocado muertes en humanos, ganado y animales domésticos y salvajes han sido objeto de investigaciones multidisciplinarias desde mediados del siglo XX.[1][2]
Las diferentes toxinas incluyen potentes neurotoxinas, hepatotoxinas, toxinas gastrointestinales, dermatológicas, citotoxinas (generales) y lipopolisacáridos.[3]
La exposición recreativa ante cianobacterias puede producir síntomas gastrointestinales, fiebre del Heno o erupciones cutáneas pruriginosas.[3]
Existe además un interés militar en el potencial de ciertas toxinas como las cianotoxinas que "han adquirido cada vez más importancia como candidatos potenciales para usarlos como armas".(Dixit et al., 2005).
Historia[editar]
Los efectos tóxicos de las cianobacterias se han reconocido desde hace más de 2 000 años, tal como lo evidencian las poblaciones indígenas de América, África y Australia, quienes desde esa antigüedad han estado prevenidos de la naturaleza venenosa de las aguas contaminadas.[3]
El primer informe científico publicado sobre los efectos letales que las cianobacterias pueden provocar, apareció en la revista Nature, en 1878. George Francis describió las floraciones de algas en el estuario del río Murray en Australia como "una espesa espuma, como una pintura aceitosa verde, de alrededor de dos a seis pulgadas de grosor." Los animales que bebieron del agua murieron de forma rápida y terrible. Identificó el organismo causal como Nodularia spumigena.[3]
Desde 1850, el lago Alexandrina del sur de Australia, que recibe las aguas del río Murray, era reconocido por los aborígenes de la zona como venenoso, con varias centenares de muertes de animales asociadas al consumo de sus aguas durante la segunda mitad del siglo XIX.[3]
La mayoría de los informes sobre envenenamiento por toxinas de microalgas indican que ocurrieron en ambientes de agua dulce, pero son cada vez más comunes y se dan en áreas más extensas. Por ejemplo, miles de patos y gansos murieron a causa de beber agua contaminada en el mediooeste de Estados Unidos. En 2010 se documentaron por primera vez casos de muertes de mamíferos marinos por la ingesta de cianotoxinas. (Miller et al., 2010)
Cianobacterias[editar]

Las cianotoxinas son producidas por las cianobacterias, un filo de bacterias que obtienen su energía a través de la fotosíntesis. El prefijo cian proviene del griego κύανoς que significa "sustancia de color azul oscuro", y normalmente se refiere a cualquier color en la gama azul/verde del espectro. Comúnmente las cianobacterias son llamadas cianofíceas o algas verdeazuladas. Tradicionalmente se pensaba que las cianobacterias eran un tipo de alga, y así se referían a ellas en los libros. Sin embargo las fuentes modernas consideran esta clasificación obsoleta, por lo que ahora se considera que están más relacionadas con las bacterias , y el término de alga se restringe únicamente a las algas eucariotas. Al igual que estas últimas, las cianobacterias son fotosintéticas por lo que contienen pigmentos fotosintéticos, razón por la cual poseen un color verdoso o azulado.(Guiry et al., 2007)(Nabors & Murray, 2004)(Allaby, 1992)
Las cianobacterias habitan en casi todas partes; en océanos, lagos, ríos así como en tierra firme. Crecen en lagos árticos y antárticos, en fuentes termales y en los tratamientos de las aguas residuales. Habitan incluso en el pelaje de los osos polares a los cuales les da un tono verdoso.(Karp, 2009)(Vasconcelos & Pereira, 2001)(Skulberg, 1996)(Castenholz, 1973)
Las cianobacterias producen tóxicos potentes, pero también sintetizan compuestos bioactivos útiles, incluyendo sustancias antitumorales, antivirales, anticancerígenas, antibióticas, antifúngicas, protectoras de la radiación ultravioleta e inhibidores específicos de ciertas enzimas. (Herrero & Flores, 2008) (Sinonen & Jones, 1999)
| Género cianobacteria | Tipo de toxina |
|---|---|
| Anabaena | Microcistinas, saxitoxinas, anatoxinas, BMAA |
| Anabaenopsis | |
| Aphanizomenon | Saxitoxinas, anatoxinas, cilindroespermopsina, lipopolisacárido |
| Aphanocapsa | Microcistinas |
| Coelosphaerium | |
| Cylindrospermopsis | Saxitoxinas, cilindroespermopsina, BMAA |
| Gloeotrichia | |
| Gomphosphaeria | |
| Lyngbya | Saxitoxinas, lingbyatoxinas |
| Microcystis | Microcistinas, BMAA |
| Nodularia | Nodularina |
| Nostoc | Microcistina, BMAA |
| Oscillatoria | Microcistinas, anatoxinas, lipopolisacárido, BMAA |
| Phormidium | |
| Planktothrix | Microcistinas, anatoxinas, lipopolisacárido, BMAA |
| Pseudanabaena | |
| Synechocystis | |
| Synechococcus |
Floraciones algales[editar]
Las cianotoxinas están a menudo implicadas en lo que comúnmente se conoce como Mareas Rojas o floraciones nocivas de algas (en inglés, bloom). Los lagos y océanos contienen gran cantidad de organismos unicelulares o fitoplancton. En ciertas condiciones, especialmente cuando las concentraciones de nutrientes son altas, estos organismos se reproducen de forma exponencial. En consecuencia se forma una densa nube de fitoplancton sobre el agua llamada "bloom" que puede extenderse sobre cientos de kilómetros cuadrados de superficie y se pueden visualizar fácilmente en imágenes de satélites. Por sí mismo, el fitoplancton no suele perdurar más que unos días, pero estas floraciones pueden durar semanas.(Lindsey & Scott, 2010)

Generalmente estas floraciones son inofensivas, pero en ocasiones pasan a ser nocivas al contener toxinas o patógenos que causan la muerte de peces e incluso de humanos. En ambientes marinos, las floraciones nocivas de algas están mayormente causadas por dinoflagelados, (Stewart & Falconer, 2008) a pesar de que otros grupos de algas pueden causarlas (diatomeas, flagelados, haptofitas y rodofíceas). Las especies marinas de dinoflagelados son frecuentemente tóxicas, en cambio las especies de agua dulce no son conocidas por serlo. Tampoco lo son las diatomeas, al menos para el ser humano (Vasconcelos, 2006).
En ecosistemas de agua dulce, las floraciones de algas son causadas normalmente por la eutrofización. Los brotes se parecen a espuma, verdín o pintura que flota sobre la superficie del agua, aunque no siempre son visibles. Tampoco han de ser siempre de color verde; pueden ser de color azul, incluso algunas especies de cianobacterias aportan un tono marrón o rojizo.
Una floración fuerte de cianobacterias puede reducir la visibilidad a uno o dos centímetros de profundidad. Las especies que no necesitan ver para migrar dentro de la columna de agua (como las propias cianobacterias) consiguen sobrevivir, pero la posibilidad de supervivencia para aquellas especies que sí necesitan visión para encontrar alimento o relacionarse con otros organismos, queda reducida. Durante del día la floración de cianobacterias satura el agua en oxígeno, en cambio por la noche la respiración de los organismos acuáticos puede agotar el oxígeno hasta el punto de que las especies más sensibles, como algunos peces, mueren. Es más probable que esto ocurra cerca del fondo marino o de la termoclina. La acidez del agua también sigue ciclos diarios a lo largo de una floración de algas. Durante el día se alcanzan pH del orden de 9 o incluso más altos, mientras que por la noche el pH cae a valores mucho más bajos. Además muchas especies de cianobacterias producen potentes cianotoxinas en gran concentración hasta el punto en el que son letales para algunos organismos acuáticos cercanos y para otros animales al contacto directo con la floración, como pájaros, animales de granjas o domésticos e incluso humanos en ciertas ocasiones.(Vasconcelos, 2006)
En 1991, una floración de cianobacterias afectó a 1000 kilómetros del río Darling-Barwon en Australia (Forc, N.S.W.B.G.A.T. 1992), y supuso un coste económico de 10 millones de dólares australianos (6,97 millones de euros). (Herath, 1995)
Estructura química[editar]
Las cianotoxinas se divide en tres grandes grupos en función de su estructura química: los péptidos cíclicos, los alcaloides y los policétidos
| Estructura | Cianotoxina | Principales órganos o funciones afectados en mamíferos | Género de cianobacterias que lo producen |
|---|---|---|---|
| Péptidos cíclicos | Microcistinas | Hígado | Microcystis, Anabaena, Planktothrix(Oscillatoria), Nostoc, Hapalosiphon, Anabaenopsis |
| Nodularinas | Hígado | Nodularia | |
| Alcaloides | Anatoxina-a | Sinapsis nerviosa | Anabaena, Planktothrix(Oscillatoria), Aphanizomenon |
| Anatoxina-a(S) | Sinapsis nerviosa | Anabaena | |
| Cilindrospermopsina | Hígado | Cylindrospermopsis, Aphanizomenon, Umezakia | |
| Lyngbyatoxin-a | Piel, tracto gastrointestinal | Lyngbya | |
| Saxitoxinas | Axones Nerviosos | Anabaena, Aphanizomenon, Lyngbya, Cylindrospermopsis | |
| Lipopolisacáridos | Irritante potencial, afecta a cualquier tejido expuesto | Todas | |
| Policétidos | Aplasiatoxina | Piel | Lyngbya, Schizothrix, Planktothrix(Oscillatoria) |
La mayoría de las cianotoxinas tienen un número de variantes (análogos). En total se conocen unas 84 cianotoxinas sin embargo sólo han sido bien estudiadas unas pocas.
Péptidos cíclicos[editar]
Un péptido es un polímero corto de aminoácidos unidos por enlaces peptídicos. Poseen la misma estructura química que las proteínas, con la excepción de que son cadenas más cortas. En un péptido cíclico, la cadena de aminoácidos se vuelve a unir al principio de ésta, formando una cadena circular estable. Para los mamíferos dicha estabilidad hace que sean resistentes a la digestión y se pueden acumular en el hígado. De todas las cianotoxinas, los péptidos cíclicos son los que más afectan a la salud humana. Las microcistinas y nodularinas son tóxicas para el hígado y en altas dosis pueden causar la muerte. (Chorus & Bartram, 1999)
Microcistinas[editar]

Como las demás cianotoxinas, las microcistinas fueron nombradas después de descubrir el primer organismo que las producía, en este caso Microcystis aeruginosa. Sin embargo, más tarde se encontró otro género de cianobacterias que también las produce (Chorus & Bartram, 1999). Existen unas 60 variantes conocidas de microcistinas, y muchas de ellas son producidas durante una floración. La microcistina más documentada es la microcistina-LR, posiblemente porque fue la primera de la cual estuvo disponible comercialmente su análisis estándar químico. (Chorus & Bartram, 1999)
Las proliferaciones que contienen microcistinas son un problema mundial. (Pelaez et al., 2010). Las microcistinas son péptidos cíclicos y pueden ser muy tóxicos para plantas y animales incluyendo humanos. Se acumulan en el hígado de los peces, en el hepatopáncreas de mejillones, y en el zooplancton. Son hepatotóxicas y causan serios daños para el hígado de los humanos.(Chorus & Bartram, 1999) En esto son similares a las nodularinas (abajo), y juntas, representan la mayor parte de las proliferaciones tóxicas de cianobacterias en aguas dulces y salobres.(Sinonen & Jones, 1999). En 2010, se documentó el envenanamiento de un número de nutrias marinas a causa de microcistinas. La fuente más probable de toxicidad por mariscos hepatotóxicos eran los bivalvos marinos. Este es el primer caso confirmado de mamíferos marinos que mueren intoxicados por ingestión de cianotoxinas.(Miller et al., 2010)
Nodularinas[editar]

La primera variante de nodularina identificada fue la Noduarina-R, producida por la cianobacteria Nodularia spumigena (Sivonen K, Kononen K, Carmichael WW, Dahlem AM, Rinehart KL, Kiviranta J, Niemela SI (1989)). Esta cianobacteria crece en todas las masas de agua del mundo. En el mar Báltico, la floración marina de Nodularia spumigena es uno de los eventos más grandes del mundo en cuanto a masas cianobacteriales. (David et al., 2009)
En general, los péptidos cíclicos producidos por la familia nodularia son las toxinas más comunes en una floración de cianobacterias, tanto en agua dulce como salobre. Al igual que las microcistinas (arriba), las nodularinas son hepatoxinas muy potentes y dañan gravemente el hígado. Suponen un riesgo para la salud de animales salvajes o domésticos así como para los humanos, y en muchas zonas plantean un reto importante en el abastecimiento de agua potable. (Sinonen & Jones, 1999)
Alcaloides[editar]
Los alcaloides son un grupo de compuestos químicos naturales que contienen principalmente átomos básicos de nitrógeno. Muchas variedades de organismos los producen, incluyendo las cianobacterias. También forman parte del grupo de los metabolitos secundarios. Los alcaloides actúan sobre diversos sistemas metabólicos de los humanos y otros animales, provocando a menudo efectos psicotrópicos o tóxicos. Suelen aportar un sabor amargo. (Rhoades & David, 1979)
Anatoxina-a[editar]
Las investigaciones sobre la anatoxina-a, también conocida como "el factor de muerte rápida", comenzaron en 1961 tras la muerte de vacas que bebieron agua de un lago en el que se dio una floración masiva de algas en Saskatchewan, Canadá. (Carmichael & Gorham, 1978) (Carmichael et al., 1975). Al menos cuatro géneros diferentes de cianobacterias producen esta toxina, encontrada en NorteAmérica, Europa, África, Asia y Nueva Zelanda. (Yang, 2007)

Los efectos tóxicos de la anatoxina-a son muy rápidos porque actúa directamente en las células nerviosas (neuronas) como una neurotoxina. Los síntomas progresivos ante una exposición de anatoxina-a son la pérdida de concentración, espasmos, convulsiones y finalmente la muerte rápida por parálisis respiratoria. Los tejidos nerviosos que se comunican con los músculos contienen un receptor llamado receptor nicotínico de acetilcolina. La estimulación de estos receptores causa una contracción muscular. La molécula de anatoxina-a tiene una estructura tal que se encaja en este receptor, como lo hace el neurotransmisor natural que es la acetilcolina. Una vez que se produce la contracción del músculo, la anatoxina-a no permite que las neuronas vuelvan a su estado de reposo, ya que la toxina no es degradada por la colinesterasa, que habitualmente si lo hace con la acetilcolina. Debido a esto la célula muscular queda contraída permanentemente, la comunicación entre el cerebro se interrumpe y la respiración cesa. (Wood et al., 2007)
Cuando la toxina fue descubierta, se la denominó Very Fast Death Factor (VFDF) debido a que al ser inyectada en ratones causaba temblores, parálisis y finalmente la muerte en pocos minutos. En 1977, se la denominó como amina alcaloide bicíclica y pasó a llamarse anatoxina-a (Devlin et al., 1977) (Moore, 1977). Estructuralmente es una sustancia similar a la cocaína. Existe un interés continuo sobre la anatoxina-a debido a los peligros que presenta para las aguas de recreo o potables, y porque es una molécula particularmente útil para investigar los receptores de la acetilcolina en el sistema nervioso.( Stewart et al., 2008) La letalidad de la toxina indica que tiene un alto potencial militar como arma biológica. (Dixit et al.,2005)
Cilindrospermopsinas[editar]

Las Cilindropermopsinas (abreviado como CYN o CYL) fueron descubiertas después de un brote de una misteriosa enfermedad en Palm Island (Australia) (Byth S (July 1980)). Dicho brote fue causado por una floración de Cylindrospermopsis raciborskii en el suministro de agua potable local, identificándose posteriormente la toxina. El análisis de la toxina reveló la estructura química propuesta en 1992, lográndose su síntesis en el 2000. Desde entonces se han aislado o sintetizado una gran cantidad de variedades de cilindrospermopsinas.(Griffiths & Saker, 2003)
La cilindrospermopsina es tóxica para el hígado y los tejidos del riñón y se piensa que puede inhibir la síntesis de proteínas así como modificar covalentemente el ARN y/o el ADN. Existe una preocupación debido a la bioacumulación de la cilindrospermopsina en organismos de agua dulce. (Kinnear, 2010) Las floraciones de géneros productores de cilindrospermopsinas se encuentran con mayor frecuencia en aguas de áreas tropicales, subtropicales o áridas, encontrándose recientemente floraciones de este tipo en Australia, Europa, Israel, Japón y Estados Unidos. (Chorus & Bartram, 1999)
Saxitoxinas[editar]
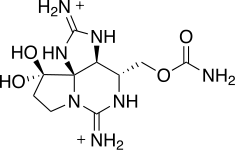
La saxitoxina (STX) es una de las neurotoxinas naturales más potentes que se conocen. El término de saxitoxina proviene del nombre de la especie de la almeja de la mantequilla (Saxidomus giganteus) , gracias a la cual se reconoció la toxina por primera vez. La saxitoxina es producida por Anabaena spp., algunas Aphanizomenon spp., Cylindrospermopsis sp., Lyngbya sp. y Planktothrix sp. (Clark et al.,1999). El pez globo y algunos dinoflagelados marinos también son productores de la saxitoxina. (Nakamuraa et al., 1984) (Landsberg, 2002). Las saxitoxinas se acumulan en los mariscos y algunos peces. La ingestión de saxitoxina a través de marisco contaminado por algas tóxicas, puede producir una intoxicación que cause parálisis.(Sinonen & Jones, 1999)
Las saxitoxinas se han usado en la biología molecular para establecer la función del canal de sodio. Actúa sobre los canales de sodio dependientes del voltaje de las células nerviosas, impidiendo una función celular correcta y conduciendo a la parálisis. El bloqueo de los canales neuronales de sodio consecuencia de una intoxicación paralítica por marisco produce una parálisis "relajada" que deja a la víctima calmada y consciente de la progresión de los síntomas. La muerte se produce por una insuficiencia respiratoria.(Kao & Levinson, 1986). La saxitoxina fue aislada y descrita por primera vez por el ejército estadounidense, que le dio el nombre de arma química "TZ". La saxitoxina aparece en el anexo 1 de la Convención sobre Armas Químicas. De acuerdo con el libro Spycraft, a los pilotos de aviones estadounidenses de reconocimiento U-2 se les proporcionó agujas que contenían saxitoxinas para usarlas como método de suicidio en caso de que la huida fuera imposible. (Wallace et al., 2009)
Lipopolisacáridos[editar]
Los lipopolisacáridos se encuentran en todas las cianobacterias. Parece que no son tan potentes como otras cianotoxinas. Algunos investigadores afirman que todos los lipopolisacáridos procedentes de cianobacterias pueden irritar la piel, mientras que otros dudan de que los efectos tóxicos sean tan generalizados.[3]
Policétidos[editar]
Los policétidos son metabolitos secundarios de bacterias, hongos, plantas y animales. Son biosintetizados por la polimerización de subunidades de acetilo y propionilo en un proceso similar a la biosíntesis de ácidos grasos. Son los bloques de construcción para un amplio rango de productos naturales.
Los policétidos son estructuralmente una familia muy diversa de productos naturales con actividades biológicas y propiedades farmacológicas diversas. En uso comercial hay antibióticos, antifúngicos, citostáticos, anticolesterolémicos, antiparasíticos, promotores del crecimiento animal, e insecticidas naturales.
Aplisiatoxinas[editar]
Es la toxina más representativa de este grupo, se clasifica como dermatotoxina, provoca irritaciones y dermatitis severas si hay contacto cutáneo. En caso de ingestión accidental producen inflamación gastrointestinal. Son producidas por cianobacterias como Lyngbya sp., Oscillatoria sp. y Schizothrix sp..
Distribución de cianotoxinas en aguas españolas[editar]
Las cianobacterias son abundantes en alrededor del 50% de los embalses investigados. Los datos sobre toxicidad indican que alrededor del 65% de las muestras en las que las cianobacterias eran abundantes presentaban cianotoxinas (50). Combinando ambos datos se puede decir que alrededor del 25% de los embalses españoles pueden presentar en algún momento cianotoxinas en concentraciones variables. Las toxinas más habituales en aguas españolas son las microcistinas, y en particular la variante LR, que es muy tóxica. (Quesada et al., 2004)
Legislación española[editar]
España es uno de los pocos países que posee legislación concreta respecto a las cianotoxinas en aguas de consumo. El Real Decreto 140/2003 establece el valor de 1 µg/L de microcistinas totales a la salida de las estaciones de tratamiento de agua potable (ETAP), pero no establece que tipos de microcistinas se han de medir ni recomienda ninguna metodología para hacerlo. El resto de variantes de cianotoxinas, como la cilondrospermopsina, que ha sido encontrada en aguas españolas en concentraciones elevadas, no están incluidas en el Real Decreto. (Quesada et al., 2004)
En cuanto a las aguas de recreo, no hay ninguna legislación, pero si hay recomendaciones de la OMS que sugieren no permitir el acceso a la zona recreativa en presencia de más de 2000 células de cianobacterias potencialmente tóxicas por mL de agua, lo que equivale a unos 10 µg de clorofila por litro de agua.
Efectos en los ecosistemas[editar]
A nivel ecológico lo más importante es la disminución de biodiversidad y la falta de oxígeno, aunque en realidad estas son consecuencias directas de la presencia del afloramiento masivo, independientemente si este es tóxico o no lo es. Sin embargo, la presencia de toxinas puede suponer una variación en las especies de zooplancton, ya que muchas son sensibles a estas toxinas, permaneciendo aquellas que son más resistentes pero con diferente valor nutricional o que simplemente no son consumidas por los peces. Esto hace que la estructura trófica del ecosistema quede desequilibrada.
Además se ha comprobado que hay acumulación de toxinas en los tejidos de los animales que las ingieren. Recientemente se han atribuido mortandades importantes de animales, como en el caso de los flamencos del parque nacional de Doñana (Alonso et al., 2002) por el efecto directo de las cianotoxinas contenidas en las cianobacterias.
Referencias[editar]
- ↑ a b Rastogi, Rajesh P; Madamwar, Datta; Incharoensakdi, Aran (noviembre de 2015). «Bloom Dynamics of Cyanobacteria and Their Toxins: Environmental Health Impacts and Mitigation Strategies» [Dinámica de las floraciones de cianobacterias y sus toxinas: Impacto en la salud ambiental y estrategias de mitigación]. Front Microbiol. 2015; 6: 1254. (en inglés) (Frontiers Media SA) 6 (456): 1254. PMID 26635737. doi:10.3389/fmicb.2015.01254. Consultado el 25 de enero de 2017.
- ↑ Stewart, Ian; Carmichael, Waine W; Backer, Lorraine C (2011). «Toxic cyanobacteria» [Cianobacterias tóxicas]. En Selendy, Janine MH, ed. Water and Sanitation Related Diseases and the Environment: Challenges, Interventions and Preventive Measures [Enfermedades y ambiente relacionados con agua y sanidad: Desafíos, intervenciones y medidas preventivas] (en inglés). John Wiley & Sons. ISBN 1118148606. Consultado el 27 de enero de 2017.
- ↑ a b c d e f Stewart, Ian; Webb, Penelope M; Schluter, Philip J; Shaw, Glen R (marzo de 2006). «Recreational and occupational field exposure to freshwater cyanobacteria – a review of anecdotal and case reports, epidemiological studies and the challenges for epidemiologic assessment» [Exposición ocupacional y recreacional a cianobacterias de agua dulce - una revisión de reporte de casos y anécdotas, estudios epidemiológicos y desafíos para la medición epidemiológica]. Environ Health (en inglés) (BioMed Central) 5 (1): 6. PMID 16563159. doi:10.1186/1476-069X-5-6. Consultado el 27 de enero de 2017.
- Stewart I, Seawright AA, Shaw GR (2008). "Cyanobacterial poisoning in livestock, wild mammals and birds – an overview" (PDF). Cyanobacterial Harmful Algal Blooms: State of the Science and Research Needs. Advances in Experimental Medicine and Biology 619: 613–637. doi:[10.1007/978http://link.springer.com/chapter/10.1007%2F978-0-387-75865-7_28-0-387-75865-7_28 10.1007/978-0-387-75865-7_28]. ISBN 978-0-387-75864-0.
- Dixit A, Dhaked RK, Alam SI, Singh L (2005). "Military potential of biological neurotoxins". Informa Healthcare 24 (2): 175–207. doi:10.1081/TXR-200057850
- Francis G (1878). "Poisonous Australian Lake". Nature 18 (444): 11–12. Bibcode:1878Natur..18...11F. doi:10.1038/018011d0.
- Miller MA, Kudela RM, Mekebri A, Crane D, Oates SC et al. (2010). "Evidence for a Novel Marine Harmful Algal Bloom: Cyanotoxin (Microcystin) Transfer from Land to Sea Otters". In Thompson, Ross. PLoS ONE 5 (9): e12576. doi:10.1371/journal.pone.0012576. PMC 2936937. PMID 20844747
- Nabors, Murray W. (2004). Introduction to Botany. San Francisco, CA: Pearson Education, Inc. ISBN 0-8053-4416-0.
- Ed. Guiry, M.D., John, D.M., Rindi, F and McCarthy, T.K. 2007. New Survey of Clare Island Volume 6: The Freshwater and Terrestrial Algae. Royal Irish Academy. ISBN 978-1-904890-31-7
- Allaby, M ed. (1992). "Algae". The Concise Dictionary of Botany. Oxford: Oxford University Press.
- Skulberg OM (1996) "Terrestrial and limnic algae and cyanobacteria". In: A Catalogue of Svalvard Plants, Fungi, Algae and Cyanobacteria, Part 9, A Elvebakk and P Prestud (eds.) Norsk Polarinstitutt Skrifter, 198: 383-395.
- Castenholz RA (1973) "Ecology of blue-green algae in hotsprings". In: The Biology of Blue-green algae. NG Carr and BA Whitton (eds), pp. 379-414. Blackwell Scientific Publications, Oxford.
- Vasconcelos VM, Pereira E (2001). "Cyanobacteria diversity and toxicity in a Wastewater Treatment Plant (Portugal)". Water Research 35 (5): 1354–1357. doi:10.1016/S0043-1354(00)00512-1. PMID 11268858
- Gerald Karp (19 October 2009). Cell and Molecular Biology: Concepts and Experiments. John Wiley and Sons. pp. 14–. ISBN 978-0-470-48337-4. Retrieved 26 January 2011.
- Herrero A and Flores E (editor). (2008). The Cyanobacteria: Molecular Biology, Genomics and Evolution. Caister Academic Press. ISBN 978-1-904455-15-8.
- Sinonen K and Jones G (1999) "Cyanobacterial Toxins" In Toxic Cyanobacteria in Water. Chorus I and Bartram J (eds): 41-111. WHO, Geneva.
- Lindsey R and Scott M (2010) What are phytoplankton NASA Earth Observatory.
- Stewart I and Falconer IR (2008) "Cyanobacteria and cyanobacterial toxins" Pages 271–296 in Oceans and human health: risks and remedies from the seas, Eds: Walsh PJ, Smith SL and Fleming LE. Academic Press, ISBN 0-12-372584-4.
- Vasconcelos V (2006). "Eutrophication, toxic cyanobacteria and cyanotoxins: when ecosystems cry for help" (PDF). Limnetica 25 (1–2): 425–432.
- Forc, N.S.W.B.G.A.T. (1992). "Final report of the NSW Blue-Green Algae Task Force". Parramatta: NSW Department of Water Resources.
- Herath, G. (1995). "The algal bloom problem in Australian waterways: an economic appraisal". Review of Marketing and Agricultural Economics 63 (1): 77–86.
- Chorus I and Bartram J (1999) Toxic cyanobacteria in water: A guide to their public health consequences, monitoring and management World Health Organisation. E & FN Spon, ISBN 0-419-23930-8.
- Pelaez M et al. (2010) "Sources and Occurrence of Cyanotoxins Worldwide". In Xenobiotics in the Urban Water Cycle, Environmental Pollution, 16(I): 101-127, doi 10.1007/978-90-481-3509-7_6
- Sivonen K, Kononen K, Carmichael WW, Dahlem AM, Rinehart KL, Kiviranta J, Niemela SI (1989). "Occurrence of the hepatotoxic cyanobacterium Nodularia spumigena in the Baltic Sea and structure of the toxin". Appl. Environ. Microbiol. 55 (8): 1990–5. PMC 202992. PMID 2506812.
- David P. Fewer DP, Köykkä K, Halinen K, Jokela J, Lyra C, Sivonen K (2009). "Culture-independent evidence for the persistent presence and genetic diversity of microcystin-producing Anabaena (Cyanobacteria) in the Gulf of Finland". Environmental Microbiology 11 (4): 855–866. doi:10.1111/j.1462-2920.2008.01806.x. PMID 19128321.
- Rhoades, David F (1979). "Evolution of Plant Chemical Defense against Herbivores". In Rosenthal, Gerald A., and Janzen, Daniel H. Herbivores: Their Interaction with Secondary Plant Metabolites. New York: Academic Press. p. 41. ISBN 0-12-597180-X.
- Carmichael WW, Gorham PR (1978). "Anatoxins from clones of Anabaena flos-aquae isolated from lakes of western Canada." Mitt. Infernal. Verein. Limnol". , 21: 285–295.
- Carmichael WW, Biggs DF, Gorham PR (1975). "Toxicology and pharmacological action of Anabaena flos-aquae toxin". Science 187 (4176): 542–544. Bibcode:1975Sci...187..542C. doi:10.1126/science.803708. PMID 803708.
- Yang, X (2007) Occurrence of the cyanobacterial neurotoxin, anatoxin-a, in New York State waters ProQuest. ISBN 978-0-549-35451-2.
- Wood S. A., Rasmussen J. P., Holland P. T., Campbell R., Crowe A. L. M. (2007). "First Report of the Cyanotoxin Anatoxin-A from Aphanizomenon issatschenkoi (cyanobacteria)". Journal of Phycology 43 (2): 356–365. doi:10.1111/j.1529-8817.2007.00318.x.
- Devlin JP, Edwards OE, Gorham PR, Hunter NR, Pike RK, Stavric B (1977). "Anatoxin-a, a toxic alkaloid from Anabaena flos-aquae NRC-44h". Can. J. Chem. 55 (8): 1367–1371. doi:10.1139/v77-189.
- Moore RE (1977). "Toxins from blue-green algae". BioScience 27 (12): 797–802. doi:10.2307/1297756. JSTOR 1297756.
- Byth S (July 1980). "Palm Island mystery disease". The Medical Journal of Australia 2 (1): 40, 42. PMID 7432268.
- Griffiths DJ, Saker ML (2003). "The Palm Island mystery disease 20 years on: a review of research on the cyanotoxin cylindrospermopsin". Environ Toxicol 18 (2): 78–93. doi:10.1002/tox.10103. PMID 12635096.
- Kinnear S (2010) Cylindrospermopsin: A Decade of Progress on Bioaccumulation Research Marine Drugs 8: 542-564; doi:10.3390/md8030542
- Clark RF, Williams SR, Nordt SP, Manoguerra AS (1999). "A review of selected seafood poisonings". Undersea Hyperb Med 26 (3): 175–84. PMID 10485519. Retrieved 2008-08-12.
- Nakamuraa M, Oshimaa Y, Yasumoto T (1984). "Occurrence of saxitoxin in puffer fish". Toxicon 22 (3): 381–385. doi:10.1016/0041-0101(84)90082-5. PMID 6474491.
- Landsberg JH, 2002. The effects of harmful algal blooms on aquatic organisms. Reviews in Fisheries Science, 10(2): 113–390.
- Kao CY and Levinson SR (1986) Tetrodotoxin, saxitoxin, and the molecular biology of the sodium channel New York Academy of Sciences. ISBN 0-89766-354-3.
- Wallace R, Melton HK and Schlesinger HR (2009) Spycraft: the secret history of the CIA's spytechs from communism to Al-Qaeda. Penguin Group USA, ISBN 0-452-29547-5.
- Stewart I, Schluter PJ, Shaw GR (2006). "Cyanobacterial lipopolysaccharides and human health - a review". Environ Health 5 (1): 7. doi:10.1186/1476-069X-5-7. PMC 1489932. PMID 16563160.
- Quesada A., Moreno, E., Carrasco, D., Paniagua, T., ; Wormer, L., De Hoyos, C, Sukenik, A. (2006). "Toxicity of Aphanizomenon ovalisporum (Cyanobacteria) in a Spanish water reservoir" Eur.
- J. Phycol., 41 (1):39-45. (49) Quesada A., Sanchis D. , Carrasco D. (2004). "Cyanobacteria in Spanish reservoirs. How frequently are they toxic?". Limnetica 23 (1-2): 109-118. (50)
- Alonso-Andicoberry C., García Villada L., Lopez-Rodas V., Costas E. (2002). "Catastrophic mortality of flamingos in a Spanish national park caused by cyanobacteria". Vet Rec., 151 (23) 706-7.(51).
Enlaces externos[editar]
- Cyanobacteria, their toxins and health risks
- Blue-Green Algae (Cyanobacteria) and their Toxins
- Harmful Bloom in Lake Atitlán, Guatemala from NASA Earth Observatory
- Anatoxin
- κύανος,
- .IOC-UNESCO Taxonomic Reference List of Harmful Micro Algae (HABs)
- Cyanobacteria, neurotoxins and water resources: Are there implications for human neurodegenerative disease?
- Chemical Weapons Convention: Schedule 1
