Cáncer de pulmón
| Cáncer de pulmón | ||
|---|---|---|
 Corte torácico en un estudio tomográfico mostrando la localización de un tumor de cáncer pulmonar. | ||
| Especialidad |
oncología neumología | |
| Síntomas | Dolor de pecho, tos, pérdida de peso, dificultad para respirar | |
| Factores de riesgo | Tabaquismo, predisposición genética, contaminación aérea, asbesto | |
| Tratamiento | Cirugía, quimioterapia, radioterapia | |

Carcinoma de células pequeñas.
El cáncer de pulmón es un conjunto de enfermedades resultantes del crecimiento maligno de células del tracto respiratorio, en particular del tejido pulmonar, y uno de los tipos de cáncer más frecuentes a nivel mundial.[1] El cáncer de pulmón suele originarse a partir de células epiteliales, y puede derivar en metástasis e infiltración a otros tejidos del cuerpo. Se excluye del cáncer de pulmón aquellas neoplasias que hacen metástasis en el pulmón provenientes de tumores de otras partes del cuerpo.[2]
Los síntomas más frecuentes suelen ser dificultad respiratoria, tos —incluyendo tos sanguinolenta— y pérdida de peso,[3] así como dolor torácico, ronquera e hinchazón en el cuello y la cara.
El cáncer de pulmón es clasificado en dos tipos principales en función del tamaño y apariencia de las células malignas: el cáncer pulmonar de células pequeñas (microcítico) y el de células no pequeñas (no microcítico). Esta distinción condiciona el tratamiento y así, mientras el primero por lo general es tratado con quimioterapia y radiación, el segundo tiende a serlo además mediante cirugía,[4] láser[5] y, en casos especiales, terapia fotodinámica.[6]
La causa más común de cáncer de pulmón es el tabaquismo,[7] siendo el 95 % de pacientes con cáncer de pulmón fumadores o exfumadores. En las personas no fumadoras, la aparición del cáncer de pulmón es resultado de una combinación de factores genéticos,[8][9] exposición al gas radón,[10] asbesto,[11] y contaminación atmosférica,[12][13][14] incluyendo humo secundario (fumadores pasivos).[15][16]
El diagnóstico temprano del cáncer de pulmón es el principal condicionante para el éxito en su tratamiento. En estadios tempranos, el cáncer de pulmón puede, en alrededor del 20 % de los casos,[17] ser tratado mediante resección quirúrgica con éxito de curación.[18] Sin embargo, debido a su virulencia y a la dificultad para su detección precoz, en la mayoría de los casos el diagnóstico se produce cuando ya ocurre metástasis; el cáncer de pulmón presenta, junto con el cáncer de hígado, páncreas y esófago los peores pronósticos, con una esperanza de vida promedio de aproximadamente 8 meses.[19]
El cáncer de pulmón es una de las enfermedades más graves y uno de los cánceres con mayor incidencia en el ser humano, responsable de los mayores índices de mortalidad oncológica a escala mundial.[20] Es la primera causa de mortalidad por cáncer en el varón y la tercera, después del de colon y mama, en la mujer,[21][22] causando más de un millón de muertes cada año en el mundo.[23] En el Reino Unido (2004) y en los Estados Unidos (2006) representa la primera causa de muerte por cáncer en mujeres y hombres. En España son diagnosticados anualmente unos 20 000 casos, lo que representa el 18,4 % de los tumores entre los hombres (18 000 casos) y el 3,2 % entre las mujeres (2000 casos).[24] A pesar de la dificultad para encontrar estadísticas consistentes entre los diferentes países de Iberoamérica y el Caribe, la supervivencia global ha ido aumentando,[24] especialmente en pacientes en tratamiento regular con quimioterapia.[25]
Historia[editar]

El cáncer de pulmón no era muy frecuente antes de la difusión del hábito tabáquico y, al menos hasta 1791 con los reportes de John Hill, no era considerada como una entidad patológica de importancia.[27][28] No fue sino hasta 1819 cuando se publicaron las características resaltantes del cáncer de pulmón, una enfermedad que para entonces resultaba difícil distinguir de la tuberculosis.[29] Para 1878, los hallazgos malignos de pulmón representaban solo el 1 % de los cánceres observados durante autopsias.[30] La cifra se elevó a 10-15 % en la primera parte del siglo XX.[30] Hasta 1912 solo se contaba con 374 casos publicados en la literatura médica sobre el cáncer de pulmón. En 1926, el cáncer pulmonar de células pequeñas fue reconocido por vez primera como una entidad de enfermedad maligna, diferente a todos los demás tipos de cáncer pulmonar.[31] Al revisar esos estudios se demuestra un aumento en la incidencia de cáncer de pulmón durante las autopsias de un 0,3 % en 1852 a un 5,66 % en 1952.
El médico alemán Fritz Lickint reportó en 1929 la primera prueba estadística que relacionaba el cáncer de pulmón con el consumo de cigarrillos,[32] lo que llevó a una impresionante campaña antitabaco en la Alemania nazi. Un estudio, iniciado en la década de 1950 por médicos británicos, detectó la primera conexión epidemiológica de evidencia sólida entre fumar y el cáncer de pulmón.[30] Como resultado, en 1964, los Estados Unidos comenzó campañas públicas sobre los efectos dañinos del fumar cigarrillos.[30]
La conexión con el radón fue reconocida por primera vez en la región de los Montes Metálicos alrededor de Schneeberg,[33] en la zona fronteriza entre Sajonia (Alemania) y Bohemia (República Checa). Esta región es muy rica en fluorita, hierro, cobre, cobalto y plata, esta última extraída desde los años 1470.[26] La presencia de grandes cantidades de uranio y radio dio lugar a una intensa y continua exposición al radón, un gas radiactivo con propiedades carcinogénicas.
Los mineros desarrollaron una cantidad desproporcionada de enfermedades pulmonares que, al hacer seguimiento epidemiológico, conllevó en 1870 al descubrimiento de ciertos trastornos variados y para entonces no reportados, que coincidían con las características, descritas años después, del cáncer de pulmón.[34] Se estima que alrededor del 75 % de estos mineros murieron de cáncer de pulmón.[26] A pesar de este descubrimiento, la minería de uranio en la Unión Soviética continuó incluso hasta los años 1950, debido a la continua demanda del metal.
La primera operación exitosa de neumonectomía para el carcinoma de pulmón se hizo el 5 de abril de 1933.[35] La radioterapia en los casos de cuidados paliativos se ha utilizado desde los años 1940, mientras que la radioterapia radical (un intento de radiación a dosis más altas) comenzó a emplearse desde la década de 1950 en adelante como terapéutica en personas con cáncer de pulmón, pero sin indicación de cirugía. En 1997, la radioterapia acelerada, continua e hiperfraccionada (CHART, por sus siglas en inglés) suplantó la radioterapia convencional radical para una neoplasia pulmonar.
En cuanto el cáncer de pulmón de células pequeñas, los abordajes quirúrgicos iniciales en 1960 y la radioterapia radical dieron resultados decepcionantes. Los regímenes de quimioterapia satisfactoria no se desarrollaron hasta la década de 1970.
Clasificación[editar]
| Forma histológica | Frecuencia (%) |
|---|---|
| Cáncer pulmonar de células no-pequeñas | 75-80 |
| Cáncer de pulmón de células pequeñas | 15-20 |
| Carcinoide[37] | <5 |
| Cáncer de pulmón no especificado | <2 |
| Sarcoma[38] | <1 |
La gran mayoría de los tipos de cáncer de pulmón son carcinomas, es decir, tumores malignos que nacen de células epiteliales. Hay dos formas de carcinoma pulmonar, categorizados por el tamaño y apariencia de las células malignas vistas histopatológicamente bajo un microscopio: los tumores de células no-pequeñas (80,4 %) y los de células pequeñas (16,8 %).[36] Esta clasificación está basada en criterios histológicos y tiene importantes implicaciones para el tratamiento y el pronóstico de la enfermedad.[39][40] Los carcinomas de células no pequeñas pueden dividirse, con la ayuda de un microscopio, en varias clases principales: los adenocarcinomas, los carcinomas de células escamosas y los carcinomas de células grandes. Existen además los carcinomas bronquioalveolares y varias formas mixtas.
Cáncer pulmonar de células no-pequeñas (NSCLC)[editar]
Los carcinomas pulmonares de células no-pequeñas se agrupan por razón de que su pronóstico y tratamiento son muy similares.[40] Existen tres subtipos principales: el carcinoma de células escamosas de pulmón, los adenocarcinomas y el carcinoma pulmonar de células grandes.
| Subtipo histológico | Frecuencia (%) | |
|---|---|---|
| Carcinoma pulmonar de células escamosas | 31,1 | |
| Adenocarcinoma | Adenocarcinoma (no especificado) | 23,2 |
| Carcinoma bronquioloalveolar | 3,0 | |
| Carcinoma adenoescamoso | 1,2 | |
| Adenocarcinoma papilar | 0,7 | |
| Carcinoma mucoepidermoide[41] | 0,1 | |
| Carcinoma adenoide cístico[42] | 0,04 | |
| Otros adenocarcinomas | 1,1 | |
| Carcinoma de células grandes | 10,7 | |
| Carcinoma de células gigantes y estrelladas | 0,4 | |
| Otros o no especificados del tipo células no-pequeñas | 8,9 | |
Cerca de un 31 % de todos los carcinomas de pulmón se corresponde con un carcinoma de células escamosas que,[36] por lo general, comienza cerca de un bronquio central.[43] Comúnmente se ve necrosis y cavitación en el centro del tumor. Aquellos tumores de células escamosas bien diferenciadas a menudo crecen más lentamente que los otros tipos de cáncer.[4]
Los adenocarcinomas representan un 29,4 % de todos los tipos de cáncer de pulmón.[36] Por lo general se originan del tejido pulmonar periférico.[43] La mayoría de los casos de adenocarcinoma de pulmón están asociados al hábito de fumar cigarrillos y en pacientes con enfermedades pulmonares previas.[44] Sin embargo, entre aquellos que nunca han fumado, los adenocarcinomas son la forma más frecuente de cáncer de pulmón.[45] Uno de los subtipos de adenocarcinomas, el carcinoma bronquioloalveolar, se ve con más frecuencia entre mujeres que nunca han fumado y generalmente muestra respuestas diferentes al tratamiento de un individuo al otro.[46] Este tumor se observa radiológicamente como una consolidación, por lo que puede confundirse con una neumonía.
Los carcinomas de células gigantes representan un 10,7 % de todas las formas de cáncer de pulmón.[36] Son tumores que crecen con rapidez y cerca de la superficie del pulmón.[47] A menudo son células pobremente diferenciadas y tienden a metastatizar pronto.[4] Se desarrollan sobre todo en pacientes de avanzada edad.
Carcinoma de células pequeñas (SCLC)[editar]

Cerca de un 15 % de todos los carcinomas de pulmón se corresponden con un cáncer de pulmón de células pequeñas, también llamado carcinoma de células de avena.[48] Tiende a aparecer en las vías aéreas de mayor calibre —como en los bronquios primarios y secundarios— y crece rápidamente llegando a tener un gran tamaño.[49] La célula de avena contiene densos gránulos neurosecretores, es decir, vesículas que contienen hormonas neuroendocrinas, que le da una asociación con un síndrome endocrino o paraneoplásico, es decir, caracterizado por síntomas no relacionados con el efecto del tumor local.[50] Aunque es un tipo de cáncer que inicialmente resulta más sensible a la quimioterapia, conlleva un peor pronóstico y se disemina mucho más rápidamente que el cáncer pulmonar de células no pequeñas.[48] Los tumores de pulmón de células pequeñas se dividen en una etapa limitada y una etapa avanzada o diseminada. Este tipo de cáncer está igualmente asociado al tabaquismo.[51] Este tumor se asocia más que los anteriores a síndromes paraneoplásicos por secreción ectópica de hormonas.[52]
Cáncer metástasis de pulmón[editar]
El pulmón es un sitio común para la metástasis diseminada desde tumores que comienzan en alguna otra parte del cuerpo.[53] Los tumores más comunes que se propagan a los pulmones son el cáncer de vejiga, cáncer de mama, cáncer de colon, los neuroblastomas, el cáncer de próstata, sarcomas y el tumor de Wilms. Estos son cánceres son identificados por el sitio de origen, de modo que un cáncer de mama en el pulmón sigue siendo un cáncer de mama. A menudo tienen una característica forma redondeada en la radiografía de tórax.[54] Los tumores primarios del pulmón hacen metástasis especialmente en las glándulas suprarrenales, hígado, cerebro y hueso.[4]
Epidemiología[editar]

A nivel mundial, el cáncer de pulmón es la forma más frecuente de cáncer en términos de incidencia y de mortalidad causando cerca de 1,0-1,18 millones de muertes cada año, con las tasas más elevadas en países de Europa y Norteamérica.[55][56] El segmento poblacional más afectado son aquellos mayores de 50 años de edad que tienen antecedentes de tabaquismo. La incidencia de cáncer de pulmón por país tiene una correlación inversa con la exposición a la luz solar o rayos ultravioleta, sugiriendo que la insuficiente irradiación de luz ultravioleta B, lo que conlleva a una deficiencia de vitamina D, pudiera contribuir con la incidencia del cáncer de pulmón.[57]
Frecuencia[editar]
El cáncer de pulmón o carcinoma broncogénico representa más del 90 % de los tumores pulmonares.[58] De este 90 %, el 93 % corresponde al cáncer de pulmón primario y un 4 % lo forman tumores secundarios o metastásicos. El 2 % corresponde al adenoma bronquial y el 1 % son tumores benignos. El término broncogénico se aplica a la mayoría de los cánceres de pulmón, pero es algo erróneo, ya que implica un origen bronquial para todos ellos, a pesar de que los adenocarcinomas, que son periféricos, son más frecuentemente de origen bronquiolar. La relación con el tabaquismo es tal que la incidencia de muerte por cáncer de pulmón es 46, 95, 108, 229 y 264 por cada 100 000 habitantes entre los que fuman media caja, ½-1 caja, 1-2 cajas, 2 cajas y más de 2 cajas diarias de cigarrillo, respectivamente.
Mortalidad[editar]
| País | Año evaluado | Varones | Mujeres |
|---|---|---|---|
| 2001-2005[60] | 31,9 | 7,45 | |
| 1999 (estimado) | 12,1 | 4,2 | |
| 1985-87 | 21,7 | 6,1 | |
| 1975-76 | 9,8 | 4,9 | |
| 1999[61] | 12,27 | 4,84 | |
| 2001-2005[60] | 37,95 | 17,16 | |
| 1985-88 | 7,4 | 2,9 | |
| 1997[62] | 58,6 | 6,4 | |
| 1997[63] | 9,05 | 4,3 | |
| 1985-86 | 11,7 | 2,3 | |
| 1980-83 | 6,8 | 2,7 | |
| 2001-2005[60] | 47,2 | 7,14 | |
| 2008[64] | 14,1 | 13,7 |
El cáncer de pulmón es una neoplasia muy agresiva: más de la mitad de los pacientes mueren antes del primer año después del diagnóstico,[65] fundamentalmente porque más de dos tercios de los individuos son diagnosticados en estados avanzados, cuando se imposibilitan los tratamientos curativos.[66] La causa más común de muerte relacionada con cáncer es el cáncer pulmonar.[67] En los Estados Unidos, más personas mueren de cáncer del pulmón que de cáncer de colon, de mama y de próstata juntos.[68][69] Mientras que en otros países, como Venezuela, la cantidad de muertes por el cáncer de pulmón es superado por el cáncer de próstata en hombres y el cáncer de mama en mujeres.[70]
Aumento de la incidencia[editar]
El número de casos ha ido en aumento desde principios del siglo XX, duplicándose cada 15 años. La incidencia ha aumentado cerca de 20 veces entre 1940 y 1970. A principios del siglo XX, se consideraba que la mayor parte de los tumores pulmonares eran metastásicos, y que el cáncer primitivo era raro. El cáncer de pulmón es menos común en países en vías de desarrollo,[71] sin embargo, se espera que la incidencia aumente notablemente en los siguientes años en esos países,[72] especialmente en China[73] y la India.[74]
Sexo[editar]
El cáncer de pulmón es la neoplasia más frecuente en el varón, especialmente en el este de Europa, con tasas cercanas a 70 casos por cada 100 000 habitantes y año en los países con más casos, y una tasa cercana a 20/100 000 en países como Colombia, Suiza y otros países que reportan las incidencias más bajas.[75] La tasa entre mujeres es aproximadamente la mitad de la de los hombres, con tasas cercanas a 30 por cada 100 000 mujeres y año en los países con más casos y una tasa cercana a 20 en países como Colombia, Suiza y otros países que reportan las incidencias más bajas.[75] India tiene una tasa de 12,1 y 3,8 por 100 000 entre hombres y mujeres respectivamente.[75] En la mujer sigue teniendo una menor incidencia, pero la muerte por cáncer de pulmón ya se ha situado en algunos países en segundo lugar después del cáncer de mama, incluso en primer lugar.[76] Aunque la tasa de mortalidad entre los hombres de países occidentales está disminuyendo, la tasa de mortalidad de mujeres por cáncer de pulmón está aumentando, debido al incremento en el número de nuevos fumadores en este grupo.[55]
Edad[editar]
El cáncer de pulmón afecta sobre todo a personas entre los 60 y los 65 años. Menos del 15 % de los casos acontecen en pacientes menores de 30 años de edad.[55] La edad promedio de las personas a las que se les detecta cáncer del pulmón es 60 años.[55] Puesto que en muchos países se ha observado un aumento en la cantidad de fumadores jóvenes, se observarán cambios en la mortalidad por edades en las próximas décadas.[55]
Etiología o causa del cáncer de pulmón[editar]
Las principales causas del cáncer de pulmón, así como del cáncer en general, incluyen carcinógenos tales como el humo del cigarrillo, radiación ionizante e infecciones virales. La exposición a estos agentes causa cambios sobre el ADN de las células, acumulándose progresivamente alteraciones genéticas que transforman el epitelio que reviste los bronquios del pulmón.[77] A medida que el daño se hace más extenso, la probabilidad aumenta de desarrollar un cáncer.[4]
Tabaquismo[editar]

Se ha establecido que el tabaco y posiblemente la contaminación atmosférica,[78] constituyen un factor causal del cáncer de pulmón.[77] Entre el 80-90 % de los cánceres de pulmón se dan en fumadores[79] o en personas que hayan dejado de fumar recientemente,[77] pero no hay evidencia de que el fumar esté asociado a una variedad histológica concreta, aunque tiende a relacionarse más con el carcinoma epidermoide y con el cáncer de células pequeñas.[80] Estadísticamente no se relaciona con el adenocarcinoma.[80] Los fumadores tienen un riesgo de 10 a 20 veces mayor de desarrollar cáncer de pulmón (según el número de cigarrillos fumados al día) que los no fumadores. Es decir, hay una relación dosis-respuesta lineal.[77]
Cuantos más años de la vida haya fumado una persona, y sobre todo si es a una edad temprana, está más relacionado con cáncer, ya que la dosis de cancerígenos es acumulativa.[81] Por ejemplo, el riesgo aumenta entre 60-70 veces en un varón que fume dos cajetillas al día durante 20 años, en comparación al no fumador. Aunque el abandono del tabaquismo reduce el riesgo de contraer cáncer de pulmón, no lo reduce a los niveles de quienes nunca fumaron.[77] Aun abandonando el hábito tabáquico[82] se mantiene un alto riesgo de cáncer de pulmón durante los primeros 5 años.[83] En la mayoría de los estudios, el riesgo de los exfumadores se aproxima al de los no fumadores después de 10 años, pero puede mantenerse elevado incluso después de 20 años. En un estudio realizado en Asturias (España), aquellos que dejaron de fumar 15 años antes de tener el cáncer de pulmón tenían 3 veces más riesgo que los no fumadores.[84]
El fumador pasivo es la persona que no fuma, pero que respira el humo del tabaco de los fumadores, ya sea en el hogar, en el trabajo o en lugares públicos. El fumador pasivo presenta niveles elevados de riesgo de contraer cáncer de pulmón, aunque inferiores en relación con el fumador activo.[85] El fumador activo tiene la posibilidad de contraer alguna enfermedad por el tabaco en un 80 % de los casos, mientras que en el fumador pasivo, el riesgo es de 23 %.[86] No hay evidencias que sugieran que el riesgo de contraer cáncer de pulmón sea más elevado en los fumadores pasivos que en los fumadores activos.
El fumar puros, habanos o pipa tiene menos probabilidades de causar cáncer de pulmón que fumar cigarrillos, aun cuando la cantidad de cancerígenos en el humo de pipa y el puro es al menos tan grande como en el de los cigarrillos.[87]
Los grupos culturales que defienden el no fumar como parte de su religión, como los Santos de los Últimos Días[88] y los adventistas del séptimo día,[89] tienen tasas mucho menores de cáncer de pulmón y de otros cánceres asociados con el consumo de tabaco.
El tabaco es el responsable del 30 % de los cánceres en general y por orden de frecuencia decreciente son: pulmón, labio, lengua, suelo de la boca, faringe, laringe, esófago, vejiga urinaria y páncreas.[81]
Comparación con la marihuana[editar]
Un estudio que comparó cigarrillos de marihuana (741 a 985 mg) y de tabaco (900 a 1200 mg), encontró que al fumar marihuana la cantidad de alquitrán inhalado se triplica y que la cantidad de alquitrán depositado en el tracto respiratorio aumenta en un tercio.[90] Muchas de las sustancias del tabaco que causan cáncer no están en los productos de la combustión de la marihuana. Algunos informes médicos indican que estos productos de la combustión de la marihuana no causarán cáncer de boca y de garganta con mayor frecuencia que los del tabaco. Sin embargo, debido a que la marihuana es una sustancia ilegal, no es fácil obtener información acerca de la relación que los productos de combustión de la marihuana tienen con el cáncer sobre la base de fundamentos moleculares, celulares e histopatológicos.[91]
Factores endógenos: genética y sexo[editar]

El cáncer de pulmón, igual que otras formas de cáncer,[93] se inicia por activación de oncogenes o inactivación de genes de supresión tumoral.[94] Los oncogenes son genes que parecen hacer que un individuo sea más susceptible de contraer cáncer. Por su parte, los protooncogenes tienden a convertirse en oncogenes al ser expuestos a determinados carcinógenos.[95]
Hay varios estudios que indican que a igual exposición al tabaco las mujeres tienen más riesgo de padecer cáncer de pulmón que los varones.[77][96] Los hermanos e hijos de las personas que han tenido cáncer de pulmón pueden tener un riesgo levemente mayor que la población general. Si el padre y el abuelo de un individuo murieron por cáncer de pulmón y este fuma, la causa más probable de su muerte será un cáncer de pulmón.
No se ha podido demostrar ningún factor responsable de la susceptibilidad genética. Sin embargo, cada día existe más evidencia de la participación de factores genéticos y otros biomarcadores de susceptibilidad en la predisposición al cáncer de pulmón,[81] entre ellos:
- La existencia de un factor genético ligado a la enzima aril-hidrocarbono-hidroxilasa (AHH) que es una enzima del metabolismo del benzopireno. Se ha observado en algunos enfermos un incremento de la AHH, enzima que tiene la capacidad de convertir los hidrocarburos policíclicos en sustancias altamente cancerígenas.[81][97] También se ha detectado en otros casos que el déficit de vitamina A podría tener un efecto similar.[98] Los datos disponibles apoyan a la hipótesis de que los carotenoides dietéticos como la vitamina A reducen el riesgo de cáncer de pulmón, aunque también sugieren la posibilidad de que algún otro factor en estos alimentos es el responsable por el menor riesgo encontrado.[99]
- Se ha demostrado la existencia de oncogenes activados en el tejido tumoral del cáncer de pulmón. Estos comprenden amplificación de los oncogenes myc en los tumores de células pequeñas, mutaciones puntuales en regiones codificadoras de oncogenes ras en distintas líneas celulares y activaciones mutacionales específicas del oncogén K-ras en tumores de células no-pequeñas como los adenocarcinomas.[100] En la actualidad se está estudiando si los incrementos o alteraciones de las proteínas expresadas por estos genes activados juegan algún papel en la patogenia del cáncer de pulmón.
- La inmunidad celular o humoral es un factor de susceptibilidad. Hasta ahora no se ha podido aclarar si la inmunodeficiencia es anterior o secundaria a la propia neoplasia.
- Los no fumadores con cáncer de pulmón presentan un incremento de variantes del oncogén p53 con genotipo Arg homocigotos.[101]
Según estudios, se ha podido definir una clasificación dentro del cáncer de pulmón basada en el número de mutaciones de copias somáticas (SCNAs)[102] que se visualizan a nivel genómico para cáncer de pulmón en pacientes no fumadores, pudiendo diferenciar los pacientes en:
- Piano: Individuos carentes de mutaciones de SCNAs. Estos individuos suelen tener mejores pronósticos, especialmente aquellos que presentan carcinoides. Algunas de las mutaciones que pueden aparecer son asociadas a los genes KRAS y UBA1.
- Mezzo-forte: Individuos cuyos genes presentan amplificaciones a nivel de brazo cromosomal (1q, 5p, 7p, 7q y 8q). Las modificaciones se suelen ver a nivel del EGFR (Receptor del Factor de crecimiento epidérmico).
- Forte: Individuos que presentan duplicaciones a nivel de todo el genoma. Las mutaciones más comunes se encuentran en TP53. La mayoría de los fumadores se encuentran dentro de este subgrupo.
Aunque la clasificación previamente establecida está determinada para pacientes no fumadores, se ve una asociación entre las características genómicas de los no fumadores forte y los individuos fumadores que presentan cáncer de pulmón.[102]
Riesgos industriales: trabajo y ocupaciones[editar]
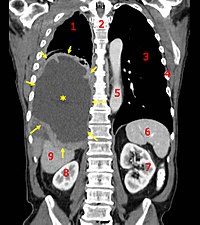
1. Pulmón derecho,
2. Columna vertebral,
3. Pulmón izquierdo,
4. Costillas,
5. Aorta,
6. Bazo,
7. Riñón izquierdo,
8. Riñón derecho,
9. Hígado.
El asbesto es otro factor de riesgo para el cáncer de pulmón. Las personas que trabajan con asbesto tienen un riesgo mayor de padecer de cáncer de pulmón y, si además fuman, el riesgo aumenta enormemente.[11] Aunque el asbesto se ha utilizado durante muchos años, los gobiernos occidentales casi han eliminado su uso en el trabajo y en los productos para el hogar. El tipo de cáncer de pulmón relacionado con el asbesto, el mesotelioma, a menudo empieza en la pleura.
Tienen riesgo aumentado de presentar cáncer de pulmón los trabajadores relacionados con la industria del asbesto, arsénico, azufre, (las tres «A») cloruro de vinilo, hematita, materiales radiactivos, cromatos de níquel, productos de carbón, gas mostaza, éteres de clorometilo, gasolina y derivados del diésel, hierro, berilio, etc. Aún el trabajador no fumador de estas industrias tiene un riesgo cinco veces aún mayor de contraer cáncer de pulmón que aquellos no asociados a ellas.[77][103] Todos los tipos de radiaciones son carcinogénicas. El uranio es débilmente radiactivo, pero el cáncer de pulmón es cuatro veces más frecuente entre los mineros de las minas de uranio no fumadores, que en la población general y diez veces más frecuente entre los mineros fumadores. El radón es un gas radiactivo que se produce por la desintegración natural del uranio. El radón es invisible y no tiene sabor ni olor. Este gas puede concentrarse en los interiores de las casas y convertirse en un posible riesgo de cáncer.[10][104][105]
Contaminación urbana y atmosférica[editar]
Es concebible que los contaminantes de la atmósfera, especialmente la urbana, jueguen algún papel en el incremento de la incidencia del carcinoma broncogénico en nuestros días. El cáncer de pulmón es más frecuente en la ciudad que en el campo,[106] debido a:[107]
- Humos de motores de explosión (coches y vehículos de motor en general) y sistemas de calefacción —el dióxido de azufre es una de las sustancias reductoras cancerígenas más importantes—.
- Partículas de brea del pavimento de las calles.
- Partículas radiactivas.
- El gas radón natural y la radiactividad son muy abundantes en algunas zonas geográficas.[10]
Aunque la mayoría de los autores reconocen la existencia de un pequeño factor urbano en la incidencia del cáncer de pulmón, el principal culpable, con aplastante diferencia numérica, es el tabaquismo.[107]
Cicatrización: patología bronquial previa[editar]
Ciertas formas periféricas del cáncer de pulmón derivan de cicatrices pulmonares. En más de la mitad de los casos de estos carcinomas asociados a cicatriz son adenocarcinomas y la interpretación patogénica supone que la malignización sea debida a la proliferación atípica de células malignas en el proceso de regeneración epitelial de estas lesiones,[108] o que hayan quedado atrapadas en el tejido de la cicatriz sustancias carcinógenas, como por ejemplo el colesterol en las lesiones tuberculosas antiguas. La hipótesis sobre este hecho asume que este atrapamiento se podría explicar por el bloqueo linfático ocasionado por la cicatriz, con acumulación de histiocitos cargados de partículas virales o sustancias químicas.[109] Algunas enfermedades que causan cicatriz potencialmente asociados a cáncer de pulmón incluyen:
- Bronquitis crónica: íntimamente asociada a fumadores y a un mayor riesgo de contraer cáncer de pulmón.[110][111]
- Tuberculosis: es una irritación crónica sobre el parénquima pulmonar que deja una cicatriz tuberculosa que favorece la aparición de cáncer de pulmón (scar carcinoma o cáncer sobre cicatriz, sobre todo el adenocarcinoma).
- Bronquiectasias, zonas de infarto pulmonar, inclusiones de cuerpos extraños, fibrosis pulmonar idiopática (el 10 % muere por cáncer broncogénico), esclerodermia y cicatrices de otra naturaleza.
Virus[editar]
Se sabe que ciertos virus pueden causar cáncer de pulmón en animales[112][113] y evidencias recientes sugieren que tienen un potencial similar en humanos. La relación de los virus con el cáncer de pulmón tiene dos bases diferentes:
- En el ámbito experimental, se supone una incidencia de metaplasia del epitelio bronquial producida por paramixovirus, el virus del papiloma humano,[114] el papovirus SV-40, el virus BK, virus JC y el citomegalovirus.[115]
- En cuanto a la patología humana, se observa una vinculación con el carcinoma bronquioalveolar, probablemente por alteración del ciclo celular y la inhibición de la apoptosis, permitiendo división celular descontrolada.
Dieta[editar]
Algunos estudios concluyen que una alimentación con pocos alimentos de clase vegetal, podría aumentar el riesgo de cáncer de pulmón en personas que están expuestas al humo del tabaco. Es posible que las manzanas,[116] las cebollas y otras frutas y alimentos de origen vegetal contengan sustancias que ofrecen cierta protección contra el cáncer de pulmón.[117]
Se piensa que ciertas vitaminas, sobre todo las vitaminas A y C, son protectoras de la mucosa bronquial, por su capacidad de inactivar los radicales libres de los carcinógenos, y por su capacidad de regular de forma precisa ciertas funciones celulares, a través de distintos mecanismos.[118] Sin embargo, no hay estudios que hayan podido demostrar que el uso prolongado de multivitaminas reduzca el riesgo de desarrollar cáncer de pulmón.[119] Investigaciones relacionadas con la vitamina E muestran evidencias concluyentes que esa vitamina tomada en grandes dosis, puede aumentar el riesgo de cáncer de pulmón, un riesgo especialmente importante entre fumadores.[119][120]
Se ha demostrado que el β-caroteno fue ineficaz como quimioprevención del cáncer de pulmón,[120] más aún, desde el año 2007 no se recomienda el uso de β-caroteno como suplemento quimiopreventivo del cáncer de pulmón en individuos con antecedentes de consumo de cigarrillos mayor a 20 paquetes-año y con antecedentes familiares o personales de cáncer de pulmón.[121] Los estudios especulan que el beta-caroteno, considerado tradicionalmente como un antioxidante podría metabolizarse a "pro-oxidante" una vez dentro del organismo humano.
Anatomía patológica[editar]
Localización del cáncer de pulmón[editar]

Desde el punto de vista topográfico predomina la localización en el pulmón derecho (relación 6:4), en los lóbulos superiores y, dentro de estos, el segmento anterior. En segundo lugar, se localiza en los lóbulos inferiores y en tercer lugar en el lóbulo medio y língula.
El tumor de Pancoast es el tumor maligno situado en el ápex pulmonar, que aparece en el 4 % de los casos y no es una variedad histopatológica.[122] Según la localización, el cáncer de pulmón se clasifica en:
- Cáncer de pulmón central: aparece a nivel de bronquios principales, lobares y segmentarios (primera, segunda y tercera generación respectivamente), hasta los de cuarta generación, es decir preferentemente en y alrededor del hilio pulmonar.[123] El origen traqueal es raro, cerca del 1 %. Se inicia con sintomatología bronquial y son accesibles con el broncoscopio. Representan el 75 % de los casos. Son cánceres centrales las variedades epidermoide (células escamosas) y el carcinoma indiferenciado de células pequeñas.[124]
- Cáncer de pulmón periférico: aparece a partir de los bronquios de quinta generación. Se inicia con clínica extrabronquial y no son accesibles con el broncoscopio. El adenocarcinoma es un ejemplo, que suele localizarse en áreas muy alejadas, junto a la pleura.[125]
Aspecto macroscópico[editar]
En su desarrollo, el carcinoma pulmonar comienza como un área de atipia citológica in situ, que durante un periodo de tiempo no conocido produce una zona de engrosamiento de la mucosa bronquial. A partir de aquí puede seguir uno de varios patrones:
- Ulceración tumoral de la mucosa: el pequeño foco, generalmente de menos de 1 cm de diámetro, al progresar adquiere el aspecto de una excrecencia verrucosa que eleva y erosiona el revestimiento epitelial. Tiene bordes mamelonados de contorno irregular.
- Tumor intrabronquial: forma una prominencia que ocupa la mayor parte de la luz del bronquio.[126]
- Infiltración circular estenosante: de crecimiento predominantemente submucoso, aunque suele acabar ulcerándose.
- Infiltración peribronquial: el tumor penetra rápidamente en la pared bronquial e infiltra el tejido peribronquial, hacia la carina o mediastino.[127]
- Invasión del parénquima: a partir de una de las formas anteriores, puede alcanzar tamaños considerables según el tiempo transcurrido hasta que se hace el diagnóstico, constituyendo una masa sólida, de consistencia firme a dura, de color grisáceo o blanquecino al corte, con algunas zonas amarillentas y focos hemorrágicos. El tumor crece en un frente amplio, produciendo una masa intraparenquimatosa en forma de coliflor que desplaza el tejido pulmonar adyacente.
- La necrosis tumoral es frecuente en la variedad epidermoide, con formación de una cavidad central que termina por infectarse muchas veces. Esta necrosis es expresión de falta de vascularización del tumor, que se realiza a través de los vasos bronquiales, y que apenas permite el aporte sanguíneo de las zonas centrales.
- Áreas de hemorragia: aparecen muchas veces asociadas a áreas de necrosis tumoral, sobre todo cuando el tumor es prominente, lo que da lugar a un moteado amarillo blanquecino y a reblandecimiento.
- Lesiones secundarias: otras lesiones asociadas son la atelectasia distal, la infección neumónica también distal a la obstrucción bronquial causada por el tumor y las bronquiectasias regionales.
Extensión o crecimiento del cáncer de pulmón[editar]
En el momento del diagnóstico menos del 20 % tienen extensión localizada, el 25 % tienen extensión a los ganglios linfáticos y el 55 % tienen metástasis a distancia.[128] El cáncer de pulmón comienza en un punto determinado de la mucosa y a partir de ahí tiene un crecimiento hacia el interior y exterior de la luz bronquial, ascendente y descendente a través de la submucosa y un crecimiento circunferencial, siguiendo un patrón de diseminación directa llamada «infiltración».
- Crecimiento submucoso: puede abarcar toda la circunferencia bronquial y sobrepasar los límites macroscópicos. A mayor crecimiento submucoso, más irresecable será el cáncer. Si no se puede extirpar un centímetro más allá del límite macroscópico, el tumor será irresecable. En su crecimiento el tumor infiltra la pared bronquial, afectando al plexo linfático submucoso, y extendiéndose después por el parénquima pulmonar según los planos intersticiales, incluido el tejido conjuntivo perivascular de los vasos pulmonares.
- El crecimiento intrabronquial será el responsable de la sintomatología bronquial como tos, hemoptisis, enfisema, atelectasia, etc.[123]
- El crecimiento extrabronquial será responsable de la sintomatología extrapulmonar intratorácica,[129] derivada de la invasión de estructuras como el mediastino, pared torácica, diafragma, venas cavas, pericardio, tumor de Pancoast, etc. La pleura visceral, que inicialmente resiste la propagación, acaba por ser invadida, infiltrándose entonces diversas estructuras intratorácicas (nervios, pericardio, etc.) o diseminándose por la superficie pulmonar (implantaciones transpleurales) o a la pleura parietal, que si es invadida también, rápidamente se verá complicada la evolución con la progresión del tumor por la pared torácica, con la afectación de estructuras óseas. En este tipo de invasión, hay primero formación de adherencias pleurales, diseminándose después las células neoplásicas a través de los vasos linfáticos neoformados a partir del plexo linfático subpleural. Esta participación linfática es muy importante y precoz en los tumores del vértice pulmonar, en conexión con el sistema linfático perineural del plexo braquial, lo que tendrá una traducción clínica importante.
El crecimiento intra y extrabronquial es constante en todo cáncer de pulmón. Solo el 20 % de los casos, el cáncer se diagnosticará en el parénquima pulmonar (localizado), y es el que tiene mejor pronóstico.
Metástasis[editar]
El 25 % de los casos diagnosticados de cáncer de pulmón, ya presentan ganglios linfáticos regionales afectados. Aun en estados iniciales, alrededor del 30 % de pacientes en estadio I de cáncer de pulmón no microcítico mueren tras la resección completa del tumor, debido a la presencia de metástasis indetectables al diagnóstico.[130]
Diseminación linfática[editar]
La frecuencia de la afectación ganglionar varía ligeramente según el patrón histológico, pero oscila alrededor del 50 %. Teniendo en cuenta la continuidad directa de los ganglios paratraqueales con los supraclaviculares, se puede establecer que todos los cánceres de pulmón derecho y los localizados en el lóbulo inferior izquierdo podrán invadir los ganglios de la fosa supraclavicular derecha, a través de la gran vena linfática; en cambio, los ganglios supraclaviculares izquierdos se afectarán exclusivamente en los tumores del lóbulo superior izquierdo, por el conducto torácico.
- Bases anatómicas del drenaje linfático:
- Linfáticos pulmonares: se incluyen aquí la red linfática subpleural y los ganglios lobares e interlobares; de estos, tienen especial importancia los situados entre el bronquio lobar medio (pulmón derecho), o segmentarios de la língula (pulmón izquierdo), y el bronquio del segmento apical del lóbulo inferior (segmento 6), ya que por sus conexiones interlinfáticas drenan linfa de todos los lóbulos en un mismo pulmón. Los ganglios hiliares representan el límite entre este grupo pulmonar y el extrapulmonar.
- Ganglios extrapulmonares: son los ganglios subcarinales, situados debajo de la bifurcación traqueal, y los ganglios paratraqueales. Los ganglios mediastínicos anteriores y paraesofágicos representan ya estaciones ganglionares alejadas.
- Ganglios extratorácicos: los grupos más importantes son el supraclavicular, los paraaórticos abdominales, los cervicales y los axilares.
- Territorios linfáticos pulmonares:
- Superior: comprende el lóbulo superior, con excepción de las porciones posterior y lateral en el lado derecho, y la porción lingular y parte del segmento anterior en el izquierdo. El drenaje linfático se hace hacia los ganglios paratraqueales y después a los ganglios supraclaviculares ipsilaterales (en el lado izquierdo hay también una importante vía de propagación a los ganglios mediastínicos anteriores).
- Medio: con las porciones antes excluidas de los lóbulos superiores y el lóbulo medio y el segmento 6 del lóbulo izquierdo inferior. El drenaje linfático se hace preferentemente a los ganglios subcarinales, y de estos, a los paratraqueales del lado correspondiente, aunque a veces solo a los paratraqueales derechos.
- Inferior: representado por todo el lóbulo inferior, excepto el mencionado segmento apical o segmento 6. El drenaje linfático se hace a los ganglios subcarinales paratraqueales derechos. Los tumores de este territorio inferior presentan con frecuencia afectación de los ganglios situados en el ligamento pulmonar (funcionalmente, estos tienen el mismo significado fisiológico que los ganglios hiliares), desde donde progresan a los ganglios subcarinales o, más rara vez, a los paraesofágicos.
- Linfangitis carcinomatosa: es un cuadro anatomopatológico muy peculiar, caracterizado por presentar una amplia zona del pulmón un aspecto edematoso y atelectásico, con regueros de infiltración que de forma radiada se extienden desde la región hiliar hacia la trama linfática subpleural periférica. Considerada hace algunos años de naturaleza metastásica, en realidad se trata de una infiltración difusa en sentido centrífugo desde los ganglios hiliares bloqueados por la proliferación de células neoplásicas hacia el plexo subpleural.
Diseminación hemática (metástasis a distancia)[editar]
El 40 % en los carcinomas de células no pequeñas y el 70 % de los carcinomas de células pequeñas presentan ya metástasis a distancia en el momento del diagnóstico.[131] Las metástasis a distancia son frecuentes, hecho que se justifica por la afectación relativamente precoz de los vasos venosos pulmonares; en la variedad histopatológica de tumores anaplásicos de células en grano de avena es casi sistemática, lo que tiene un pésimo significado pronóstico. Las metástasis afectan preferentemente, y en orden decreciente, a hígado (30-50 %), cerebro (20 %), esqueleto (20 %) y riñón, siendo también alta la incidencia en las glándulas suprarrenales, lo que se observa en cerca del 30-50 % de las autopsias de enfermos fallecidos por cáncer de pulmón.[132] Tal vez se trate del resultado de una diseminación linfática distante por conexión de los ganglios paraaórticos con otros grupos retroperitoneales, y no por vía hematógena. Finalmente, también hay que citar las metástasis en el propio pulmón, como resultado de una embolización a través de la arteria pulmonar. No obstante, la existencia de varias masas tumorales, unilaterales o bilaterales, hace también considerar que se trate de diseminaciones broncógenas, como se admite en los tumores bronquioalveolares.
Diagnóstico[editar]
En la mayoría de los pacientes el diagnóstico se plantea ante datos clínicos y cuando en un estudio radiológico se detecta alguna anormalidad pulmonar. Con menos frecuencia se tratará de precisar el diagnóstico en enfermos a los que en un estudio rutinario radiológico se les ha puesto de manifiesto una imagen sospechosa o bien se intenta localizar el tumor ante un estudio histológico que muestra células neoplásicas.
Pruebas complementarias generales[editar]
Se suelen realizar exámenes complementarios a los pacientes con cáncer de pulmón para determinar el estado general del paciente, incluyendo la historia clínica y exploración física completas, recuento hemático completo, bioquímica sanguínea (electrólitos, glucosa, calcio y fósforo séricos y función hepática y renal, la albúmina y la LDH), electrocardiograma, pruebas de función pulmonar como la espirometría y la determinación de gases en la sangre arterial, pruebas de coagulación, marcadores tumorales como el antígeno carcinoembrionario (CEA) y alfa-fetoproteína (AFP).
Radiografía simple de tórax[editar]

En las radiografías simples de tórax se puede observar alguna anormalidad en casi el 98 % de los pacientes con un carcinoma broncogénico, y el 85 % son imágenes sugestivas para sospechar el diagnóstico por las alteraciones pulmonares distales (atelectasia), la existencia de adenopatías (ensanchamiento mediastínico) o detección de invasión de la pared torácica. La radiografía de tórax detecta elementos sospechosos en la mayoría de los pacientes con tumores pulmonares.[133] No se recomiendan las tomas radiológicas en serie para la detección temprana del cáncer de pulmón.[121]
Tomografía axial computarizada[editar]

La tomografía axial computarizada es de gran utilidad en el cáncer de pulmón y se recomienda en todo paciente con un nódulo pulmonar solitario detectado por radiografía.[121] Algunas ventajas de una tomografía incluyen:
- Encuentra su principal aplicación en la determinación del grado de extensión de la neoplasia; tanto intratorácica como extratorácica, y de las adenopatías mediastínicas.[134]
- En la diferenciación entre nódulos benignos y malignos, además de la detección de pequeños nódulos con mayor nitidez que en las radiografías simples. Proporcionan valiosa información sobre la existencia de cavitación, calcificación y en ocasiones la localización intrabronquial del tumor, en fin, de las características morfológicas del tumor.
La tomografía es un método muy demostrativo de la afectación mediastínica del carcinoma de pulmón, de la evaluación de los ganglios retroperitoneales, crurales, así como del estado del hígado, suprarrenales y riñón, frecuentemente afectados por metástasis. Permite además el análisis de lesiones subpleurales y la visualización de pequeños derrames, la posible afectación de pared —ya que permite una correcta visualización de la pared costal— y la visualización de la extensión del tumor a otras estructuras colindantes.
Broncoscopia[editar]
Con el broncoscopio rígido se puede explorar un amplio territorio bronquial que comprende tráquea, bronquios principales y bronquios lobares inferiores en visión directa. Por medio de ópticas es posible llegar a visualizar la salida de los bronquios lobares superiores. Su limitación viene dada por la imposibilidad de introducirse en bronquios segmentarios y obtener muestras de lesiones periféricas. Por el contrario, el broncofibroscopio consigue una visualización prácticamente total del árbol bronquial, llegando a territorios realmente periféricos, obteniéndose, sin duda, un aumento considerable de la rentabilidad. La broncoscopia rígida apenas se utiliza, quedando completamente desplazada por la fibrobroncoscopia.
La broncoscopía permite la visualización directa del tumor, ya que la mayoría de estos son centrales y accesibles con esta técnica exploratoria.[123]
Citología[editar]
La citología del esputo es el procedimiento diagnóstico más habitual en pacientes con sospecha de cáncer de pulmón y debe constituir la primera técnica a utilizar en todo paciente sospechoso de padecer un cáncer de pulmón, bien porque así lo sugieren la clínica y la radiología, bien porque, aun no siendo sugerentes, se trate de un individuo de alto riesgo. A partir del año 2007, no se recomienda realizar una citología de esputo individual o en serie para el tamizaje en el cáncer de pulmón.[121]
La punción para aspiración con aguja fina (PAAF) es útil especialmente en el diagnóstico del carcinoma broncogénico. Tiene una sensibilidad del 80 %,[135] que mejora en ciertas ubicaciones torácicas a un 100 % guiada con ultrasonido endoscópica.[136] Solo está indicada en tumores periféricos no accesibles a la fibrobroncoscopia o en tumores de situación media en los que reiteradamente ha fallado la obtención de material inflamatorio o necrótico.[137] En masas de 3-4 cm de diámetro o mayores se alcanza una rentabilidad alrededor del 80 %, pero consigue obtener material de lesiones tan pequeñas como nódulos de 1 centímetro de diámetro.
Biopsia[editar]
La biopsia entrega la máxima certeza al diagnóstico de un cáncer de pulmón. Hay distintas modalidades dependiendo de las circunstancias clínicas, siendo la principal la biopsia bronquial o transbronquial en el curso de una fibrobroncoscopia. La biopsia pulmonar percutánea, transparietal o transpleural se realiza generalmente con control radiológico usando diversos métodos como la biopsia aspirativa, la biopsia con aguja cortante y el taladro ultrarrápido de aire comprimido.
La principal indicación es en aquellos tumores periféricos de difícil o imposible acceso por otros procedimientos. Si el tumor es periférico y existe derrame pleural se puede recurrir a una biopsia pleural. Se puede hacer con diferentes tipos de aguja, siendo la más empleada la de Vim-Silverman. En caso de sospecha de metástasis se indica la biopsia ganglionar obtenida mediante mediastinoscopia o la biopsia percutánea de ganglios palpables. Otros tipos de biopsia, incluyendo la biopsia ósea o de médula ósea pueden ser útiles en algunos pacientes.
Mediastinoscopia[editar]
La mediastinoscopia está encaminada a la visualización del mediastino anterior, por lo general para extraer tejido (biopsia) de un ganglio linfático que rodea las vías respiratorias o de cualquier tumor inusual.[138] Se realiza una pequeña incisión en la base del cuello y se introduce un dispositivo llamado mediastinoscopio hasta la parte media del tórax, pudiendo llegar al hilio pulmonar.[139] A pesar de ser una técnica invasiva, distintos estudios han demostrado su eficacia en la estadificación preoperatoria del cáncer de pulmón y en el diagnóstico de lesiones mediastinales.[140]
Otros estudios[editar]
El empleo de isótopos radiactivos, principalmente macroagregados de albúmina marcada con I131 o Tecnecio 99 para el estudio de la perfusión pulmonar. También se encuentra disponible la gammagrafía con Galio 67 para la detección de metástasis, sobre todo ganglionares. Se realiza con bleomicina marcada con Co57 o con Ga67.
Otra técnica que se emplea es la Tomografía por Emisión de Positrones (PET) que utiliza glucosa marcada con un átomo radiactivo.
Los estudios de la extensión intratorácica y extratorácica emplean diferentes metodologías exploratorias y con varias finalidades, incluyendo conocer la extensión del tumor o de las metástasis.
Determinación del estadiaje[editar]
Por muchas razones, entre ellas comparar los resultados del tratamiento, es de gran utilidad la existencia de un método uniforme TNM para la determinación del estadio del cáncer en función de su extensión anatómica en el momento del diagnóstico.
| Estadiaje | Criterios | |
|---|---|---|
| Carcinoma oculto | TX, N0, M0 | |
| Estadio 0 | TIS, Carcinoma in situ | |
| Estadio I | IA | T1, N0, M0 |
| IB | T2, N0, M0 | |
| Estadio II | IIA | T1, N1, M0 |
| IIB | T2, N1, M0 o T3, N0, M0 | |
| Estadio III | IIIA | T3 (o T1 o T2 con N2), N0, N1 o N2, M0 |
| IIIB | Cualquier T, N3 (o cualquier N con T4), M0 | |
| Estadio IV | Cualquier T, cualquier N o M1 | |
Tumor primario (T):
- T0 - No hay signos de un tumor primario.
- TX - Cáncer oculto, demostrado en la citología del lavado bronquial, pero no radiológicamente ni en la fibrobroncoscopia. Las secreciones broncopulmonares contienen células malignas, pero no hay otros datos de la existencia de un cáncer de pulmón.
- TIS - Carcinoma in situ
- T1 - Tumor menor o igual de 3 cm en su diámetro mayor, rodeado por tejido pulmonar o pleural visceral y sin invasión proximal al bronquio lobar en la fibrobroncoscopia. También se clasifican en T1 los tumores poco frecuentes, superficiales, de cualquier tamaño, con invasión limitada a la pared bronquial que se extienden proximalmente al bronquio principal.
- T2 - Tumor mayor de 3 centímetros en su diámetro mayor o tumor de cualquier tamaño que invade la pleura visceral o con atelectasia o neumonitis obstructiva que se extiende a la región hiliar. En la broncoscopia, la extensión proximal del tumor puede limitarse al bronquio lobar o estar al menos a 2 cm de la carina. La atelectasia o la neumonitis obstructiva no deben afectar a todo un pulmón.
- T3 - Tumor de cualquier tamaño con extensión directa a la pared costal (incluidos los tumores de la cisura superior) diafragma, pleura mediastínica o pericardio, sin afectación del corazón, grandes vasos, tráquea, esófago, cuerpos vertebrales o un tumor del bronquio principal a menos de 2 cm de la carina, sin infiltración de la misma. La atelectasia afecta a todo un pulmón. Existe derrame pleural no maligno.
- T4 - Tumor de cualquier tamaño con infiltración del mediastino o del corazón, grandes vasos, tráquea, esófago, cuerpos vertebrales o carina o con derrame pleural maligno. Los derrames pleurales no hemáticos ni exudativos y con varios estudios citológicos negativos no se clasifican como malignos con fines de determinación del estadio.
Ganglios linfáticos regionales (N):
- N0 - Sin metástasis demostrables en los ganglios linfáticos
- N1 - Metástasis en los ganglios linfáticos peribronquiales o hiliares ipsolaterales, o ambos, incluyendo la extensión directa del tumor.
- N2 - Metástasis en los ganglios mediastínicos o subcarínicos ipsolaterales.
- N3 - Metástasis en los ganglios mediastínicos o hiliares contralaterales, escalénico ipso o contralateral o supraclaviculares.
Metástasis a distancia (M):
- M0 - Sin metástasis a distancia conocidas.
- M1 - Metástasis a distancia presentes, especificando su localización por ejemplo en cerebro.
La International Association for the Study of Lung Cancer clasifica el cáncer microcítico de pulmón, solamente en dos estadios: enfermedad localizada al tórax y enfermedad diseminada fuera del tórax.[141]
Tratamiento del cáncer de pulmón[editar]
Las opciones de tratamiento para el cáncer de pulmón son cirugía, radioterapia y quimioterapia, solas o combinadas, dependiendo según el estado del cáncer, el tipo celular del cáncer y cuanto se ha diseminado, así como el estado de salud del paciente.[3] Por esta razón, es muy importante que se realicen todas las pruebas diagnósticas necesarias para determinar el estado del cáncer.
Cirugía[editar]
Si las investigaciones diagnósticas confirman la presencia de cáncer de pulmón, una tomografía puede determinar si la enfermedad está localizada y si es posible el abordaje quirúrgico o si la diseminación es tal que no puede ser curada con cirugía. También se espera que se hagan exámenes de sangre y de función pulmonar para determinar si el paciente está en condiciones de ser operado y si le quedará suficiente tejido pulmonar sano después de la cirugía. Si se descubre una reserva respiratoria deficiente, como en el caso de fumadores con enfermedad pulmonar obstructiva crónica, puede que la cirugía esté contraindicada. Algunos avances en técnicas quirúrgicas han hecho posible la cirugía en pacientes con serios problemas médicos coexistentes.[142]
Algunos procedimientos quirúrgicos incluyen:
- Si se extirpa un lóbulo del pulmón, el procedimiento se llama lobectomía.[143]
- Si se extirpa todo el pulmón, la cirugía se denomina neumonectomía.[143]
- La extirpación de parte de un lóbulo se conoce como segmentectomía o resección en cuña.[143]
En aquellos pacientes con una reserva respiratoria adecuada, la lobectomía es el abordaje preferido por razón de que minimiza la probabilidad de una recurrencia localizada. Si las funciones pulmonares del paciente son bajas, se aconseja una resección en cuña.[144] Las posibles complicaciones incluyen hemorragia importante, infección de las heridas y neumonía. Debido a que el cirujano debe realizar el corte a través de las costillas para llegar al pulmón, las costillas dolerán por un tiempo después de la cirugía. Las actividades se limitan durante al menos uno o dos meses.
La cirugía de pulmón tiene una tasa de muerte post-operatoria cercana de 4,4 %, dependiendo de la función pulmonar y otros factores de riesgo.[145]
Criterios de irresecabilidad
Se entiende por resecabilidad la posibilidad de extirpación quirúrgica de todo el tejido tumoral. La presentación de tumores intratorácicos extrapulmonares son contraindicación quirúrgica absoluta porque son irresecables. La función de los criterios de irresecabilidad es precisar las contraindicaciones quirúrgicas, operando tan solo a los pacientes a los que se les puede resecar completamente el tumor evitando las toracotomías inútiles. Algunos criterios que hacen que un cáncer de pulmón sea irresecable incluyen:
- Metástasis a distancia: se incluye en este concepto, además de la afectación de diferentes órganos y estructuras, bien sea más de uno a la vez o un solo órgano con extensión tumoral difusa[146] (hígado, hueso, cerebro, suprarrenales, piel, etc.), la infiltración de la grasa pre-escalénica supraclavicular (el tejido adiposo ubicado en la profundidad de la región supraclavicular, delante de los músculos escalenos), la afectación de adenopatías cervicales o de otro territorio ganglionar fuera del mediastino (supraclaviculares) o el Síndrome de Horner.[147]
- Síndrome de la vena cava superior o de la inferior,[147] ya sea por infiltración o compresión o las dos a la vez. Aquí la radioterapia tiene indicación urgente.
- Compromiso de ambos lóbulos hepáticos.[148]
- Afectación extensa de la pared torácica o derrame pleural[149] conteniendo células neoplásicas (descubiertas por citología o biopsia positiva), metastásico o hemorrágico.
- Cualquier estadio T4. Suelen tener una escala de rendimiento de Karnofsky menor del 50%,[147] indicando que su capacidad de realizar tareas reducidas está reducida a un 50%.
Criterios de inoperabilidad
Se establecen en función de la situación clínico-funcional del enfermo: situación en que se encuentra antes de la intervención, y posibilidad de soportar funcionalmente el grado de resección pulmonar que en cada caso se precise.
- Según las características generales del sujeto:
- Edad cronológica avanzada. Se establece normalmente en personas mayores de 75-80 años.
- Enfermedad cardiovascular importante: infarto agudo de miocardio reciente (de menos de 3-6 meses de evolución), arritmias, hipertensión maligna, insuficiencia cardiaca refractaria, accidente cerebrovascular agudo.
- Enfermedad grave asociada no controlable: coagulopatías, insuficiencia renal en hemodiálisis, cirrosis, diabetes evolucionada.
- Malnutrición.
- Según la función respiratoria:
- VEMS preoperatorio inferior a 1 L, o inferior al 50 % del teórico. Con VEMS entre 1 y 2 litros mejorará con broncodilatadores y dejar de fumar. Con FEV1 o VEMS>2 L no hay problema.
- VEMS postoperatorio calculado inferior a 8 dL; La resección impediría al paciente llevar una actividad física normal, porque tendría disnea de reposo.
- Capacidad vital inferior al 45-50 %.
- Difusión inferior al 50 %.
- Paciente con enfisema, bronquitis crónica, con patrón radiológico obstructivo, restrictivo o mixto y capacidad funcional disminuida.
- Insuficiencia respiratoria: pO2<60 mmHg y pCO2> 45 mmHg.
En situaciones límite deberá realizarse, por un lado, estudio funcional con xenón midiendo porcentajes de ventilación y perfusión en cada pulmón por separado e incluso cateterismo derecho. Por otro, valoración de la posibilidad de intervención en función de estos datos y de la resección que deba realizarse para extirpar la tumoración.
Radioterapia[editar]
La radioterapia implica el uso de radiación ionizante, como los rayos X de alta energía, para destruir las células cancerosas y reducir el tamaño de los tumores.[150]
En la radioterapia externa se utiliza radioterapia generada en el exterior del cuerpo por medio de un acelerador lineal y que se concentra en el cáncer. Este tipo de radioterapia es el que se usa con más frecuencia para tratar un cáncer primario del pulmón o sus metástasis en otros órganos.[143]
En la radioterapia interna o braquiterapia se utilizan pequeñas pastillas de material o isótopo radiactivo que se colocan directamente en el área cancerosa o en la vía aérea próxima al área cancerosa.[143] Este tipo de braquiterapia generalmente es de tipo paliativo y su principal indicación es una atelectasia obstructiva por el cáncer. La braquiterapia en los márgenes de la resección puede reducir la recurrencia.[151]
Algunas veces se usa la radioterapia como el tratamiento principal del cáncer del pulmón, especialmente cuando la salud general del paciente es demasiado pobre como para someterse a una cirugía.[152] También se puede usar para ayudar a aliviar el bloqueo de las grandes vías aéreas causado por el cáncer.
Se puede usar la radioterapia después de la cirugía para destruir restos muy pequeños de cáncer que no se pueden ver ni extirpar durante la cirugía (enfermedad microscópica residual). Además, la radioterapia se puede usar para aliviar algunos síntomas de cáncer del pulmón como dolor, hemorragia, dificultad para tragar, y problemas causados por las metástasis cerebrales.[58]
Los efectos secundarios de la radioterapia pueden incluir problemas leves en la piel, náuseas, vómitos y cansancio.[153] Frecuentemente estos efectos secundarios duran un corto espacio de tiempo. La radioterapia también puede empeorar los efectos de la quimioterapia. La radioterapia en el tórax puede dañar los pulmones y causar dificultad para respirar. El esófago se encuentra en el centro del tórax y estará expuesto a la radioterapia. Por esta razón, es posible que se experimente dificultad para tragar durante el tratamiento (esofagitis).[154] Estos efectos mejorarán después de finalizar el tratamiento.
Quimioterapia[editar]
La quimioterapia consiste en la administración de medicamentos antineoplásicos o citostáticos por vía intravenosa u oral para impedir la multiplicación de las células cancerosas.[155] Estos medicamentos entran en el torrente sanguíneo y llegan a todas las áreas del cuerpo, lo cual permite que este tratamiento sea útil incluso para aquellos cánceres que se han propagado o metastatizado en órganos distantes del pulmón.[156] Dependiendo del tipo y del estadio del cáncer del pulmón, la quimioterapia se puede administrar como tratamiento principal (primario) o como tratamiento auxiliar (adyuvante) a la cirugía o la radioterapia. Generalmente en la quimioterapia para el cáncer del pulmón se utiliza una combinación de medicamentos contra el cáncer (poliquimioterapia).
El cisplatino (CDDP), o su similar, el carboplatino, son los agentes quimioterápicos que se usan con más frecuencia para tratar el cáncer del pulmón de células no pequeñas (NSCLC).[157] Estudios recientes han encontrado que la combinación de cualquiera de estos con medicamentos como gemcitabina, paclitaxel, docetaxel, etopósido (VP-16), o vinorelbina parece mejorar la eficacia en el tratamiento del NSCLC.[158] La gemcitabina se aprobó inicialmente para el tratamiento del cáncer de páncreas y es ahora ampliamente usado en el tratamiento del NSCLC.[159] La vinorelbina es un alcaloide que inhibe la mitosis en células en la fase M del ciclo celular al inhibir la polimerización de la tubulina.[160] La mielosupresión, es decir, una reducción en la producción de la línea granulocítica de los glóbulos blancos es el único efecto adverso que limita la dosificación de estos medicamentos.[19] Se continúa investigando en estudios clínicos la mejor manera de utilizar esta combinación de medicamentos.[159] Otros medicamentos han aparecido con resultados prometedores, tal como el pemetrexed, recomendado para estados avanzados locales e incluso metastásicos del NSCLC.[161]
Algunas de las combinaciones usuales de medicamentos en la quimioterapia utilizada para pacientes con cáncer del pulmón de células pequeñas (SCLC) incluyen:[123]
- EP (etopósido y cisplatino)
- ET (etopósido y carboplatino)
- ICE (ifosfamida, carboplatino y etopósido)
- CAV (ciclofosfamida, doxorrubicina o adriamicina y vincristina).
Los nuevos medicamentos como gemcitabina, paclitaxel, vinorelbina, topotecán y tenipósido han mostrado resultados prometedores en algunos estudios de SCLC.[162][163] Si la salud del paciente es relativamente buena, es posible que se administren dosis más altas de quimioterapia junto con medicamentos denominados factores de crecimiento (factor estimulante de colonias de neutrófilos o macrófagos y eritropoyetina). Estos ayudan a prevenir los efectos secundarios de la quimioterapia en la médula ósea.
Los medicamentos de la quimioterapia destruyen las células cancerosas, pero también dañan algunas células normales.[156] Los efectos secundarios de la quimioterapia dependen del tipo de medicamentos que se usen, la cantidad que se administre y la duración del tratamiento. Los efectos secundarios temporales pueden incluir náuseas y vómitos, pérdida del apetito (anorexia), pérdida del cabello (alopecia) y aparición de llagas en la boca (mucositis).[156] Ya que el cisplatino, vinorelbina, docetaxel o paclitaxel pueden dañar los nervios, es posible que se experimente adormecimiento, particularmente en los dedos de las manos y los pies, y algunas veces debilidad en los brazos y piernas (neuropatía).[164]
Algunos estudios han sugerido que los cannabinoides derivados de la marihuana usados durante la quimioterapia han reducido las náuseas y vómitos asociados al tratamiento, permitiendo al paciente comer.[165]
Terapia[editar]
Recientemente, se ha aprobado en algunos países la terapia biológica o inmunoterapia para el tratamiento del cáncer de pulmón. La inmunoterapia puede indicarse en conjunto con la cirugía, la quimioterapia y la radioterapia. Estas terapias biológicas utilizan el sistema inmune del cuerpo, ya sea directa o indirectamente, para combatir el cáncer o para disminuir los efectos secundarios que pueden causar algunos tratamientos del cáncer.[166] Los compuestos aprobados para cáncer de pulmón son inhibidores de tirosina quinasas del EGFR (receptor del factor epidérmico de crecimiento) como erlotinib y gefitinib (solo en pacientes con EGFR mutado); anticuerpos monoclonales como cetuximab (dirigido contra EGFR) o bevacizumab (dirigido contra el receptor del factor de crecimiento del entorilo vascular o VEGFR) en combinación con quimioterapia; y crizotinib en pacientes con traslación de los genes EML4-ALK.[167] En Argentina y Cuba está aprobado racotumumab,[168] un anticuerpo monoclonal que induce respuesta inmune contra gangliósidos NGc presentes en células tumores.
El progreso que se ha realizado en cuanto a entender la biología y los mecanismos oncogenéticos del cáncer de pulmón ha permitido el desarrollo de tratamientos basados en la composición molecular de las células cancerosas. Algunas de las dianas moleculares estudiadas incluyen el factor de crecimiento vascular y sus receptores, así como el receptor del factor de crecimiento epidérmico.[169] Estos medicamentos parecen ser más seguros y eficaces en ciertos subtipos histológicos del cáncer de pulmón, en particular el de células no-pequeñas y sus estadios avanzados.[170] La única desventaja hasta ahora es que se requiere de un diagnóstico histológico del cáncer.
Prevención del cáncer de pulmón[editar]
La prevención primaria a través del abandono o del evitar el consumo de tabaco, junto con una detección temprana, representan las medidas de control del cáncer de pulmón más importantes.[19] Los esfuerzos anti-tabáquicos comenzados desde los años 1970 han resultado en una estabilización de la tasa de mortalidad por cáncer de pulmón en los varones blancos, en tanto que entre las mujeres los casos están todavía en aumento, ya que ese grupo ha aumentado la prevalencia de consumo, disminuido la edad de inicio y aumentado la cantidad de cigarrillos fumados.[171] No todos los casos de cáncer de pulmón son debidos a fumar cigarrillos, pues el papel del fumador pasivo ha estado incrementando su importancia como factor riesgo de la aparición del cáncer de pulmón.[171] Ello ha incentivado la creación de políticas para disminuir el contacto con el humo del cigarrillo entre no-fumadores.
El humo proveniente de automóviles, industrias y plantas energéticas también suponen un riesgo de cáncer de pulmón.[12][14][172] Los complejos multivitamínicos tomados a largo plazo no ayudan a prevenir el cáncer de pulmón, mientras que la vitamina E parece aumentar el riesgo de cáncer de pulmón en fumadores.[119]
Prevención secundaria[editar]
Para evitar que el cáncer de pulmón alcance a manifestarse clínicamente, las políticas de salud se enfocan en el diagnóstico o la detección precoz de la enfermedad a través de programas de pesquisa y control del tumor. Otra manera de realizar prevención secundaria es mediante el conocimiento por parte de la población a través de campañas publicitarias de los síntomas iniciales de sospecha del cáncer de pulmón. No se recomienda el cribado con radiografía de tórax ni con citología de esputo en personas asintomáticas.[173]
Es probable que la detección precoz del cáncer de pulmón a través de pesquisas no reduzcan las cifras de mortalidad, aunque se ha demostrado que mejora la supervivencia de los pacientes diagnosticados con la enfermedad.[174]
Referencias[editar]
- ↑ por MedlinePlus (mayo de 2010). «Cáncer de pulmón». Enciclopedia médica en español. Consultado el 4 de junio de 2010.
- ↑ Arias, Jaime (2000). Enfermería médico-quirúrgica, Volumen 1. Editorial Tebar. p. 119. ISBN 8495447037.
- ↑ a b Minna, JD (2004). Harrison's Principles of Internal Medicine. McGraw-Hill. pp. 506-516. ISBN 0071391401. doi:10.1036/0071402357.
- ↑ a b c d e Vaporciyan, AA; Nesbitt JC, Lee JS et al. (2000). Cancer Medicine. B C Decker Inc. pp. 1227-1292. ISBN 1-55009-113-1.
- ↑ Terapia fotodinámica y carcinoma no microcítico:
- Diaz-Jimenez JP, Martinez-Ballarin JE, Llunell A y col. (1999). «Efficacy and safety of photodynamic therapy versus Nd-YAG laser resection in NSCLC with airway obstruction». Eur Respir J (en inglés) 14: 800-805. Consultado el 30 de agosto de 2010.
- David G. Pfister y col. (2004). «American Society of Clinical Oncology Treatment of Unresectable Non–Small-Cell Lung Cancer Guideline: Update 2003». Journal of Clinical Oncology 22 (2): 330-353. doi:10.1200/JCO.2004.09.053. Consultado el 30 de agosto de 2010.
- ↑ Terapia fotodinámica y carcinoma no microcítico:
- Donna E. Maziak; Jean A. MacKay; William K. Evans; Barbara R. Markman (2004). «Photodynamic therapy in nonsmall cell lung cancer: a systematic review». Ann Thorac Surg (en inglés) 77: 1484-1491. Archivado desde el original el 18 de octubre de 2009. Consultado el 30 de agosto de 2010.
- Caviedes S., Iván y col. (2003). «Terapia fotodinámica: aplicación en dos pacientes con metástasis endobronquiales de adenocarcinoma extrapulmonar». Rev chil enferm respir 19 (1): 38-42. ISSN 0717-7348. doi:10.4067/S0717-73482003000100008. Consultado el 30 de agosto de 2010.
- Lam S, Kostashuk E C, Coy E P y col. (1987). «A randomized comparative study of the safety and efficacy of photodynamic therapy using Photofrin II combined with palliative radiotherapy versus palliative radiotherapy alone in patients with inoperable obstructive non-small cell bronchogenic carcinoma». Photochem and Photobiol 47 (1): 893-897. PMID 2450381.
- ↑ «Lung Carcinoma: Tumors of the Lungs». Merck Manual Professional Edition, Online edition. Consultado el 16 de enero de 2010.
- ↑ Gorlova, OY; Weng SF, Zhang Y et al. (julio de 2007). «Aggregation of cancer among relatives of never-smoking lung cancer patients». International Journal of Cancer 121 (1): 111-118. PMID 17304511.
- ↑ Hackshaw, AK; Law MR, Wald NJ (octubre de 1997). «The accumulated evidence on lung cancer and environmental tobacco smoke». British Medical Journal 315 (7114): 980-988. PMID 9365295. Consultado el 10 de agosto de 2007.
- ↑ a b c Catelinois, O; Rogel A, Laurier D et al. (mayo de 2006). «Lung Cancer Attributable to Indoor Radon Exposure in France: Impact of the Risk Models and Uncertainty Analysis». Environmental Health Perspectives (National Institute of Environmental Health Science) 114 (9): 1361-1366. PMID 16966089. doi:10.1289/ehp.9070. Consultado el 10 de agosto de 2007.
- ↑ a b O'Reilly, KM; Mclaughlin AM, Beckett WS, Sime PJ (marzo de 2007). «Asbestos-related lung disease». American Family Physician 75 (5): 683-688. PMID 17375514. Archivado desde el original el 29 de septiembre de 2007. Consultado el 18 de agosto de 2007.
- ↑ a b Kabir, Z; Bennett K, Clancy L (febrero de 2007). «Lung cancer and urban air-pollution in dublin: a temporal association?». Irish Medical Journal 100 (2): 367-369. PMID 17432813.
- ↑ Coyle, YM; Minahjuddin AT, Hynan LS, Minna JD (septiembre de 2006). «An ecological study of the association of metal air pollutants with lung cancer incidence in Texas.». Journal of Thoracic Oncology 1 (7): 654-661. PMID 17409932.
- ↑ a b Chiu, HF; Cheng MH, Tsai SS et al. (diciembre de 2006). «Outdoor air pollution and female lung cancer in Taiwán.». Inhalation Toxicology 18 (13): 1025-1031. PMID 16966302.
- ↑ U.S. Department of Health and Human Services. "The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General", 2006.
- ↑ WHO International Agency for Research on Cancer "Tobacco Smoke and Involuntary Smoking" IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 83, 2002.
- ↑ vivirmejor.es, ed. (octubre, 2007). «Sólo el 20% de los cánceres de pulmón se pueden operar». Archivado desde el original el 17 de marzo de 2011. Consultado el 10 de julio de 2009.
- ↑ Pilar Garrido (febrero, 2004). El Mundo del Siglo XXI, ed. «¿Qué porcentaje de casos de cáncer de pulmón se cura?». Consultado el 10 de julio de 2009.
- ↑ a b c Katzung, Bertram G. (2007). «Chapter 55. Cancer Chemotherapy». Basic & Clinical Pharmacology (9 edición). McGraw-Hill. ISBN 0071451536.
- ↑ Martínez Hernández, Juan (2003). «Principales neoplasias: Pulmón, mama, cérvix, colon, estómago, próstata, leucemias, linfomas y epiteliomas. Epidemiología, factores de riesgo y prevención». Nociones de salud pública. Díaz de Santos. ISBN 8479785624. «Véase página 174.»
- ↑ OMS (2004). «Deaths by cause, sex and mortality stratum» (PDF). World Health Organization. Consultado el 1 de junio de 2007.
- ↑ «Lung Cancer Facts (Women)». National Lung Cancer Partnership. 2006. Archivado desde el original el 9 de julio de 2007. Consultado el 26 de mayo de 2007.
- ↑ OMS (febrero de 2006). «Cancer». Organización Mundial de la Salud. Consultado el 25 de junio de 2007.
- ↑ a b Asociación Española Contra el Cáncer, ed. (julio, 2007). «El cáncer de pulmón en cifras, AECC». Archivado desde el original el 19 de julio de 2008. Consultado el 10 de julio de 2009.
- ↑ Cardona AF y col (julio, 2007). Rev Venez Oncol 2010;22(1):66-83, ed. «Supervivencia de pacientes con cáncer de pulmón de célula no pequeña». Consultado el 24 de diciembre de 2010.
- ↑ a b c Greaves, Mel (2004). Cáncer el legado evolutivo. Editorial Critica. p. 221. ISBN 8484323625.
- ↑ Moya de Madrigal, Ligia (1989). Introducción a la estadística de la salud: Curso básico para estudiantes de ciencias de la salud. Editorial Universidad de Costa Rica. p. 23. ISBN 9977670498.
- ↑ «Vista de HISTORIA DEL CÁNCER DE PULMÓN: DESDE DOLL Y HILL HASTA LAS TERAPIAS DE PRECISIÓN | Medicina». revistamedicina.net. Archivado desde el original el 13 de septiembre de 2021. Consultado el 13 de septiembre de 2021.
- ↑ Olson, James Stuart (1989). The history of cancer: an annotated bibliography. ABC-CLIO. p. 235. ISBN 0313258899.
- ↑ a b c d Hanspeter Witschi (2001). A Short History of Lung Cancer (artículo completo disponible en inglés). Toxicological Sciences 64, pág 4-6. Último acceso 22 de julio de 2010.
- ↑ Hansen, H.H. (2003). «Historia cronológica del tratamiento del cáncer de pulmón de célula pequeña». Revisiones en cáncer 17 (3): 125-130. Consultado el 28 de marzo de 2010.
- ↑ Cornwell, John (2005). Los científicos de Hitler: ciencia, guerra y el pacto con el diablo. Editorial Paidós. p. 179. ISBN 8449316928.
- ↑ Istituto superiore di sanità (Italia) (2004). El ambiente y la salud: epidemiología ambiental. Editorial Abya Yala. p. 18. ISBN 9978224742.
- ↑ Senra Varela, Avellino (2005). Comentarios hipocráticos sobre cultura y saber médico. Ediciones Díaz de Santos. p. 119. ISBN 8479786655.
- ↑ ">Horn, L; Johnson DH (July de 2008). «Evarts A. Graham and the first pneumonectomy for lung cancer». Journal of Clinical Oncology 26 (19): 3268-3275. PMID 18591561. doi:10.1200/JCO.2008.16.8260.
- ↑ a b c d e f Travis, WD; Travis LB, Devesa SS (enero de 1995). «Lung cancer». Cancer 75 (Suppl. 1): 191-202. PMID 8000996.
- ↑ Morandi, U; Casali C, Rossi G (2006). «Bronchial typical carcinoid tumors». Seminars in Thoracic and Cardiovascular Surgery 18 (3): 191-198. PMID 17185178.
- ↑ Etienne-Mastroianni, B; Falchero L, Chalabreysse L et al. (diciembre de 2002). «Primary sarcomas of the lung: a clinicopathologic study of 12 cases». Lung Cancer 38 (3): 283-289. PMID 12445750.
- ↑ Centros para el Control y la Prevención de Enfermedades Prevención y Control del Cáncer. «Importancia de la clasificación histológica para el tratamiento y seguimiento del cáncer de pulmón». Consultado el 7 de octubre de 2009.
- ↑ a b Instituto Nacional del Cáncer (febrero de 2008). «Clasificación celular del cáncer de pulmón de células no pequeñas». Consultado el 22 de julio de 2010.
- ↑ Sánchez-Mora, N; Parra-Blanco V, Cebollero-Presmanes M et al. (enero de 2007). «Mucoepidermoid tumors of the bronchus. Ultrastructural and immunohistochemical study». Histology and Histopathology 22 (1): 9-13. PMID 17128406.
- ↑ Moran, CA; Suster S, Koss MN (marzo de 1994). «Primary adenoid cystic carcinoma of the lung. A clinicopathologic and immunohistochemical study of 16 cases». Cancer 73 (5): 1390-1397. PMID 7509254.
- ↑ a b Netter, Frank H.; Buja, Maximiliam; Krueger, Gerhard (2006). «Tumores pulmonares y pleurales». Anatomía patológica. Elsevier. ISBN 9788445815632.
- ↑ Travis WD, Travis LB, DeVesa SS. Lung Cancer. Cancer 1995; 75:191-202. PMID 8000996 con Erratum publicado en Cancer 1995 Jun 15;75(12):2979.
- ↑ Subramanian, J; Govindan R (febrero de 2007). «Lung cancer in never smokers: a review». Journal of Clinical Oncology (American Society of Clinical Oncology) 25 (5): 561-570. PMID 17290066.
- ↑ Raz, DJ; He B, Rosell R, Jablons DM (marzo de 2006). «Bronchioloalveolar carcinoma: a review». Clinical Lung Cancer (Cancer Information Group) 7 (5): 313-322. PMID 16640802.
- ↑ Veronesi G; Morandi U, Alloisio M et al. (julio de 2006). «Large cell neuroendocrine carcinoma of the lung: a retrospective analysis of 144 surgical cases». Lung Cancer 53 (1): 111-115. PMID 16697073. doi:10.1016/j.lungcan.2006.03.007.
- ↑ a b por MedlinePlus (agosto de 2009). «Cáncer pulmonar de células pequeñas». Enciclopedia médica en español. Consultado el 4 de julio de 2010.
- ↑ Collins, LG; Haines C, Perkel R, Enck RE (enero de 2007). «Lung cancer: diagnosis and management». American Family Physician (American Academy of Family Physicians) 75 (1): 56-63. PMID 17225705. Archivado desde el original el 29 de septiembre de 2007. Consultado el 3 de septiembre de 2008.
- ↑ Rosti, G; Bevilacqua G, Bidoli P et al. (marzo de 2006). «Small cell lung cancer». Annals of Oncology 17 (Suppl. 2): 5-10. PMID 16608983. doi:10.1093/annonc/mdj910. Consultado el 6 de septiembre de 2007.
- ↑ Barbone, F; Bovenzi M, Cavallieri F, Stanta G (diciembre de 1997). «Cigarette smoking and histologic type of lung cancer in men» (PDF). Chest (American College of Chest Physicians) 112 (6): 1474-1479. PMID 9404741. doi:10.1378/chest.112.6.1474. Consultado el 7 de septiembre de 2007.
- ↑ Jurado Gámez B, García de Lucas MD, Gudín Rodríguez M. Cáncer de pulmón y síndromes paraneoplásicos [Lung cancer and paraneoplastic syndromes]. An Med Interna. 2001 Aug;18(8):440-6. Spanish. PMID: 11589085.
- ↑ por MedlinePlus (abril de 2008). «Cáncer metastásico al pulmón». Enciclopedia médica en español. Consultado el 10 de noviembre de 2009.
- ↑ Seo, JB; Im JG, Goo JM et al. (2001). «Atypical pulmonary metastases: spectrum of radiologic findings». Radiographics 21 (2): 403-417. PMID 11259704. Consultado el 10 de septiembre de 2007.
- ↑ a b c d e Rubin, Philip; Jacqueline P. Williams (2003). Oncologia Clínica (8va edición). Elsevier, España. p. 823. ISBN 8481746274.
- ↑ «Commonly diagnosed cancers worldwide». Cancer Research UK. Apr 2005. Archivado desde el original el 10 de enero de 2008. Consultado el 11 de enero de 2008.
- ↑ Mohr, SB; Garland CF, Gorham ED et al. (2008). «Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer?». Journal of Epidemiology and Community Health 62 (1): 69-74. PMID 18079336. doi:10.1136/jech.2006.052571.
- ↑ a b Manual Merck de Información Médica para el Hogar (2005-2008). «Tumores pulmonares». Archivado desde el original el 27 de marzo de 2012. Consultado el 6 de agosto de 2010.
- ↑ Tasa de mortalidad ajustada por edad, expresada como casos por 100.000 habitantes por año.
Referencia: Boffetta P, et al. Int. J. Epidemiol 22:377-384; 1993 - citada en: Algranti E, et al. Lung Cancer in Brazil. Seminars in Oncology 28:143-152; 2001. - ↑ a b c LORIA, Dora et al. Tendencia de la mortalidad por cáncer en Argentina, Cuba y Uruguay en un período de 15 años (en español). Rev Cubana Salud Pública [online]. 2010, vol.36, n.2 [consultado 2010-05-29], pp. 0-0. ISSN 0864-3466.
- ↑ INCIDENCIA Y MORTALIDAD DEL CÁNCER EN COSTA RICA 1990-2003
- ↑ José Franco, Santiago Pérez-Hoyos, Pedro Plaza. Changes in lung-cancer mortality trends in Spain (en inglés). International Journal of Cancer. Volume 97 Issue 1, Pages 102 - 105. Último acceso 29 de mayo de 2010.
- ↑ TOVAR-GUZMAN, Víctor José; BARQUERA, Simón and LOPEZ-ANTUNANO, Francisco J. Tendencias de mortalidad por cánceres atribuibles al tabaco en México (en español). Salud pública Méx [online]. 2002, vol.44, suppl.1 [consultado 2010-05-29], pp. s20-s28. ISSN 0036-3634. doi: 10.1590/S0036-36342002000700006.
- ↑ Frecuencia del cáncer de pulmón, expresada como casos por 100.000 habitantes por año.
Referencia: GLOBOCAN 2008 (IARC) Section of Cancer Information (en inglés). Último acceso 3 de junio de 2010. - ↑ Stevens, Alan; James Lowe (2001). Anatomía patológica (2da edición). Elsevier, España. p. 216. ISBN 848174512X.
- ↑ The Information Centre for Health and Social Care and RCP (diciembre de 2006). «National Lung Cancer Audit, Report for the audit period 2005» (en inglés). Archivado desde el original el 1 de septiembre de 2012. Consultado el 9 de diciembre de 2010.
- ↑ por MedlinePlus (2008). «Cáncer». Enciclopedia médica en español. Consultado el 24 de julio de 2010.
- ↑ National Lung Cancer Partnership (junio de 2010). «Lung Cancer Info: FAQs» (en inglés). Archivado desde el original el 3 de agosto de 2010. Consultado el 24 de julio de 2010.
- ↑ Centros para el Control y Prevención de Enfermedades (marzo de 2010). «Lung Cancer Statistics» (en inglés). Consultado el 24 de julio de 2010.
- ↑ CAPOTE NEGRIN, Luis G. Aspectos epidemiológicos del cáncer en Venezuela. Rev. venez. oncol. [online]. dic. 2006, vol.18, no.4 [consultado el 24 julio de 2010], p.269-281. ISSN 0798-0582.
- ↑ «Gender in lung cancer and smoking research» (PDF). Organización Mundial de la Salud. 2004. Consultado el 26 de mayo de 2007.
- ↑ Toh CK. The changing epidemiology of lung cancer (en inglés). Methods Mol Biol. 2009;472:397-411. PMID 19107445
- ↑ Liu, BQ; Peto R, Chen ZM et al. (noviembre de 1998). «Emerging tobacco hazards in China: 1. Retrospective proportional mortality study of one million deaths». British Medical Journal 317 (7170): 1411-1422. PMID 9822393. Consultado el 27 de septiembre de 2007.
- ↑ Behera, D; Balamugesh T (2004). «Lung cancer in India». Indian Journal of Chest Diseases and Allied Sciences 46 (4): 269-281. PMID 15515828.
- ↑ a b c Surveillance and Risk Assessment Division, CCDP, Health Canada; citado por www.wrongdiagnosis.com. «Statistics about Lung cancer». Diseases (en inglés). Archivado desde el original el 21 de agosto de 2008. Consultado el 8 de mayo de 2008.
- ↑ Office on Women's Health in the U.S. Department of Health and Human Services (agosto de 2003). «Lung Cancer». National Women's Health Information Center (en inglés). Archivado desde el original el 1 de enero de 2009. Consultado el 8 de mayo de 2008.
- ↑ a b c d e f g Kumar, Vinay; Ramzi S. Cotran y Stanley L. Robbins (2008). Patología humana (7ma edición). Elsevier, España. p. 500. ISBN 8481746665.
- ↑ Piédrola Gil, Gonzalo (2000). Medicina preventiva y salud pública (10ma edición). Elsevier, España. p. 309. ISBN 8445810243.
- ↑ Samet, JM; Wiggins CL, Humble CG, Pathak DR (mayo de 1988). «Cigarette smoking and lung cancer in New Mexico». American Review of Respiratory Disease 137 (5): 1110-1113. PMID 3264122.
- ↑ a b RACHTAN Jadwiga. Smoking, passive smoking and lung cancer cell types among women in Poland Archivado el 13 de enero de 2009 en Wayback Machine. (en inglés). Lung cancer; 2002, vol. 35, no2, pp. 129-136 (26 ref.). ISSN 0169-5002. Último acceso 3 de mayo de 2008.
- ↑ a b c d WANG, SOPHIA SSAMET, JONATHAN M. Tabaquismo y cáncer: la promesa de la epidemiología molecular. Salud pública Méx [online: en inglés]. 1997, vol. 39, no. 4, pp. 331-345. Consultado el 3 de mayo de 2008. [1]. ISSN 0036-3634. doi: 10.1590/S0036-36341997000400011
- ↑ Tammemagi, CM; Neslund-Dudas C, Simoff M, Kvale P (enero de 2004). «Smoking and lung cancer survival: the role of comorbidity and treatment». Chest (American College of Chest Physicians) 125 (1): 27-37. PMID 14718417. doi:10.1378/chest.125.1.27. Consultado el 10 de agosto de 2007.
- ↑ Abandono del hábito y el riesgo de cáncer:
- Hammond EC. Smoking in relation to the death of one million men and women. J Natl Cancer Inst Monogr 1996;19:127-204. PMID: 5905667
- Rogot E, Murray J. Cancer mortality among non-smokers in an insured group of U.S. veterans. J Natl Cancer Inst 1980;65:1663-8. PMID: 6933248
- Doll R, Peto R. Mortality in relation to smoking: 20 years' observations on male British doctors. Br Med J 1976;25:1525-36
- ↑ CAICOYA, M. y MIRON, J.A. Cáncer de pulmón y tabaco en Asturias: Un estudio de casos y controles (artículo completo disponible en español). Gac Sanit [online]. 2003, vol.17, n.3 [consultado el 24 de diciembre de 2009], pp. 226-230. ISSN 0213-9111.
- ↑ CDC (diciembre de 1986). «1986 Surgeon General's report: the health consequences of involuntary smoking». CDC. PMID 3097495. Consultado el 10 de agosto de 2007.
- ↑ Alatorre, Alfredo (2004). Que es el Cáncer?: Respuestas a las preguntas más frecuentes (10ma edición). SELECTOR. p. 75. ISBN 9706437754.
- ↑ Puros, habanos y pipas en asociación con el cáncer de pulmón:
- McKeown, Thomas (1989). Introducción a la medicina social (4ta edición). Siglo XXI. pp. 134-135. ISBN 9682310539.
- Brun, Jean (1995). Sócrates (4ta edición). Publicaciones Cruz O., S.A. pp. 93-94. ISBN 9682001595.
- Elizondo, Luz Leticia (2002). Cuidemos nuestra salud. Editorial Limusa. p. 143. ISBN 968184758X.
- ↑ Joseph L. Lyon, Kent Gardner and Richard E. Gress. Cancer Incidence among Mormons and Non-Mormons in Utah (United States) 1971-85 (en inglés). Cancer Causes & Control, Vol. 5, No. 2 (Mar., 1994), pp. 149-156. Último acceso 3 de mayo de 2008.
- ↑ Gary E. Fraser1,, W. Lowrence Beeson y Ronald L. Phillips2. Diet and Lung Cancer in California Seventh-day Adventists (en inglés). American Journal of Epidemiology Vol. 133, No. 7: 683-693. Último acceso 3 de mayo de 2008.
- ↑ WU, Tzu-Chin and Tashkin, Donald P. and Djahed, Behnam and Rose, Jed E. (1988). «Pulmonary Hazards of Smoking Marijuana as Compared with Tobacco». New England Journal of Medicine 318 (6): 347-351. Consultado el 29 de abril de 2015.
- ↑ MEHRA Reena; MOORE Brent A.; CROTHERS Kristina; TETRAULT Jeanette; FIELLIN David A. The association between marijuana smoking and lung cancer: A systematic review Archivado el 13 de enero de 2009 en Wayback Machine. (en inglés). Archives of internal medicine. 2006, vol. 166, no13, pp. 1359-1367 [9 page(s) (article)]. ISSN 0003-9926. Último acceso 3 de mayo de 2008.
- ↑ Thompson, Margaret W.; Robert L. Nussbaum, James Scott Thompson, Roderick R. McInnes, Huntington F. Williard (2004). Genética en medicina (4ta edición). Elsevier, España. p. 351. ISBN 8445812254.
- ↑ CANAS, Miryan, MORAN, Yeinmy, CAMARGO, María Eugenia et al. Polimorfismo del codón 72 de TP53 y riesgo de cáncer gástrico: estudio caso-control en individuos de la región centroccidental de Venezuela. Invest. clín. [online]. jun. 2009, vol.50, no.2, p.153-161. Último acceso 21 Julio 2010. ISSN 0535-5133.
- ↑ Fong, KM; Sekido Y, Gazdar AF, Minna JD (octubre de 2003). «Lung cancer. 9: Molecular biology of lung cancer: clinical implications». Thorax (BMJ Publishing Group Ltd.) 58 (10): 892-900. PMID 14514947.
- ↑ Salgia, R; Skarin AT (marzo de 1998). «Molecular abnormalities in lung cancer». Journal of Clinical Oncology 16 (3): 1207-1217. PMID 9508209.
- ↑ Palacios (2000). Salud y Medicina de la mujer. Elsevier, España. p. 11. ISBN 848174476X.
- ↑ Tabaquismo. Programa para dejar de fumar. Ayuntamiento de Madrid, Area de Salud y Consumo, 2.ª edición. Ediciones Díaz de Santos, 2003
- ↑ Miller AB; Harve AR (1989). «Diet and lung cancer». Chest 96: 8S-9S. doi:10.1378/chest.96.1_Supplement.8S. Consultado el 8 de septiembre de 2010. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Willett WC (1990). «Vitamin A and lung cancer». Nutr Rev 48 (5): 201-11. PMID 2196482. Consultado el 8 de septiembre de 2010.
- ↑ Aviel-Ronen, S; Blackhall FH, Shepherd FA, Tsao MS (julio de 2006). «K-ras mutations in non-small-cell lung carcinoma: a review». Clinical Lung Cancer (Cancer Information Group) 8 (1): 30-38. PMID 16870043.
- ↑ Murata M, Tagawa M, Kimura M, Kimura H, Watanabe S, Saisho H. Analysis of a germ line polymorphism of the p53 gene in lung cancer patients; discrete results with smoking history (artículo completo disponible en inglés). Carcinogenesis 1996; 17:261-264. Último acceso 21 de julio de 2010. PMID 8625447
- ↑ a b Zhang, Tongwu; Joubert, Philippe; Ansari-Pour, Naser; Zhao, Wei; Hoang, Phuc H.; Lokanga, Rachel; Moye, Aaron L.; Rosenbaum, Jennifer et al. (2021-09). «Genomic and evolutionary classification of lung cancer in never smokers». Nature Genetics (en inglés) 53 (9): 1348-1359. ISSN 1546-1718. doi:10.1038/s41588-021-00920-0. Consultado el 18 de enero de 2023.
- ↑ A. Senra Varela: El cáncer, epidemiología, etiología, diagnóstico y prevención, 2002, Ediciones Harcourt S.A., ISBN 84-8174-639-8
- ↑ Torres-Duran, María; Fernandez-Villar, Alberto; Barros-Dios, Juan Miguel; Ruano-Ravina, Alberto (1 de septiembre de 2016). «Residential Radon: The Neglected Risk Factor in Lung Cancer Risk Scores». Journal of Thoracic Oncology 11 (9): 1384-1386. ISSN 1556-0864. doi:10.1016/j.jtho.2016.05.018. Consultado el 16 de noviembre de 2023.
- ↑ Cori, Liliana; Curzio, Olivia; Donzelli, Gabriele; Bustaffa, Elisa; Bianchi, Fabrizio (2022-01). «A Systematic Review of Radon Risk Perception, Awareness, and Knowledge: Risk Communication Options». Sustainability (en inglés) 14 (17): 10505. ISSN 2071-1050. doi:10.3390/su141710505. Consultado el 16 de noviembre de 2023.
- ↑ Trends in lung cancer mortality (artículo completo disponible en inglés). Thorax 1983;38:721-723. Último acceso 24 de julio de 2010.
- ↑ a b MOLINA ESQUIVEL, Enrique; BARCELO PEREZ, Carlos; BONITO LARA, Luis Antonio y DEL PUERTO QUINTANA, Conrado. Factores de riesgo de cáncer pulmonar en Ciudad de La Habana. Rev Cubana Hig Epidemiol [online]. 1996, vol.34, n.2 [consultado el 24 de julio de 2010], pp. 13-25. ISSN 1561-3003.
- ↑ Bakris, GL; Mulopulos GP, Korchik R, Ezdinli EZ, Ro J, Yoon BH (agosto 1983). «Pulmonary scar carcinoma. A clinicopathologic analysis.». Cancer. 52 (3): 493-7. Consultado el 5 de julio de 2010.
- ↑ Lima, Catherine; Hugo lapaze y Rafael García-Bunuel (1971). «"Scar" carcinoma of the lung». Chest 59: 219-222. Consultado el 5 de julio de 2010. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ J. Rimington. Smoking, Chronic Bronchitis, and Lung Cancer (en inglés). Br Med J. mayo de 1971; 2(5758):373–375. Consultado el 30 de diciembre de 2010.
- ↑ Young RP, Hopkins RJ, Christmas T, Black PN, Metcalf P, Gamble GD (August de 2009). «COPD prevalence is increased in lung cancer, independent of age, sex and smoking history». Eur. Respir. J. 34 (2): 380-6. PMID 19196816. doi:10.1183/09031936.00144208.
- ↑ Leroux, C; Girard N, Cottin V et al. (Mar-abril 2007). «Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep». Veterinary Research 38 (2): 211-228. PMID 17257570.
- ↑ Palmarini, M; Fan H (noviembre de 2001). «Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer». Journal of the National Cancer Institute (Oxford University Press) 93 (21): 1603-1614. PMID 11698564. doi:10.1093/jnci/93.21.1603.
- ↑ Cheng, YW; Chiou HL, Sheu GT et al. (abril de 2001). «The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women». Cancer Research (American Association for Cancer Research) 61 (7): 2799-2803. PMID 11306446. Consultado el 11 de agosto de 2007.
- ↑ Giuliani, L; Jaxmar T, Casadio C et al. (septiembre de 2007). «Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma». Lung Cancer 57 (3): 273-281. PMID 17400331.
- ↑ Manzanas (en español). North Carolina Department of Agriculture and Consumer Services. Último acceso 5 de julio de 2010.
- ↑ Murray, Michael T. (2004). La curación del cáncer, métodos naturales. Ediciones Robinbook. p. 81. ISBN 8479276584.
- ↑ Rakel, D. (2008). Medicina integrativa (2da edición). Elsevier, España. p. 829. ISBN 8445819119.
- ↑ a b c Zosia Chustecka; Charles Vega (febrero de 2008). «Multivitamins Do Not Reduce Risk for Lung Cancer, and Vitamin E May Raise It» (en inglés). Medscape Medical News. Consultado el 13 de mayo de 2008. «The long-term use of supplemental multivitamins does not reduce the risk of developing lung cancer, and high doses of vitamin E may even raise the risk, particularly in smokers. These conclusions from a large, prospective study tie in with previous research, say the investigators.»
- ↑ a b Serra Majem, Lluís (2006). Nutrición y salud pública: métodos, bases científicas y aplicaciones (2da edición). Elsevier, España. p. 388. ISBN 8445815288.
- ↑ a b c d Laurie Barclay; Hien T. Nghiem (septiembre de 2007). «New Guidelines Issued on Lung Cancer Diagnosis and Management» (en inglés). Medscape Medical News. Consultado el 13 de mayo de 2008.
- ↑ CLAVERO R, JOSÉ M, VILLANUEVA G, PABLO, SOLOVERA R, MARÍA E et al. Tumor de Pancoast con lesión hipofísiaria sincrónica. Rev. chil. enferm. respir. [online]. sep. 2007, vol.23, no.3 [consultado el 2 mayo de 2008], p.197-202. Disponible en la World Wide Web: [2]. ISSN 0717-7348.
- ↑ a b c d Irfan Maghfoor y col. Marzo de 2006. Lung Cancer, Oat Cell (Small Cell) (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). (artículo completo disponible en inglés). eMedicine.com (WebMD): Oncología. Último acceso 3 de septiembre de 2008.
- ↑ Kane, Madeleine A.; Paul A. Bunn (1998). Biology of lung cancer (en inglés). Informa Health Care. p. 503. ISBN 0824701321.
- ↑ Terasaki H; Niki T y col (2003). «Lung adenocarcinoma with mixed bronchioloalveolar and invasive components: clinicopathological features, subclassification by extent of invasive foci, and immunohistochemical characterization». Am J Surg Pathol 27 (7): 937-951. PMID 12826886. Consultado el 11 de septiembre de 2010.
- ↑ TULESKI, MARCELO JOSÉ, ESCUISSATO, DANTE LUIZ and BARROS, JOÃO ADRIANO DE. Imagem por ressonância magnética em paciente jovem com hemoptise e radiografia de tórax normal. J. Pneumologia [online]. 2000, vol. 26, no. 2 [cited 2008-05-16], pp. 81-82. Available from: [3]. ISSN 0102-3586. doi: 10.1590/S0102-35862000000200007
- ↑ BERNAL BERNAL, R., LEÓN JIMENEZ, A., JAÉN OLASOLO, J. et al. Recidiva local tras la cirugía del cáncer de pulmón no microcrítico: Factores pronósticos. An. Med. Interna (Madrid). [online]. 2008, vol. 25, no. 2 [consultado el 16 de mayo de 2008], pp. 55-60. Disponible en: [4]. ISSN 0212-7199.
- ↑ CIPRIANI THORNE, Enrique, FAUSTOR, Jessica, HERRERA, Percy et al. Caso Clínico en el Hospital Nacional Arzobispo Loayza. Rev Med Hered. [online]. jul./set. 2004, vol.15, no.3 [consultado el 31 de julio de 2010], p.166-172. ISSN 1018-130X.
- ↑ Uribe-Etxebarria, Naia; Mónica Lorenzo,Unai Jiménez,Isidoro Calvo,Juan Carlos Rumbero,Rafael Rojo y Joaquín Pac (2006). «Lipoma endobronquial. Consideraciones terapéuticas». Cir Esp 80 (2): 109-110. Archivado desde el original el 27 de marzo de 2010. Consultado el 10 de febrero de 2010.
- ↑ Coleman RE. Skeletal complications of malignancy (artículo completo disponible en inglés). Cancer 1997; 80: 1588-1594. Último acceso 3 de julio de 2010.
- ↑ Castillo MC, Mesch GJ, Ignacio Benavente EP, Blanco NM. Neoplasia pulmonar. Revisión de datos clínicos, diagnósticos y terapéuticos Archivado el 27 de agosto de 2010 en Wayback Machine.. Revista de Posgrado de la VIa Cátedra de Medicina - N.º 150 – Octubre 2005. Pág. 13-17. Último acceso 5 de julio de 2010.
- ↑ Albert, Richard K. (2001). Tratado de Neumologia. Elsevier, España. p. 43.6. ISBN 8481745278.
- ↑ Manual Merck de Información Médica para el Hogar (2005-2010). «Lung Cancer». Lung and Airway Disorders (en inglés). Consultado el 16 de septiembre de 2010.
- ↑ MAINIERI-HIDALGO, José A. y BRENES-DITTEL, Alejandro. Cáncer de pulmón (en español). Acta méd. costarric. [online]. mar. 2003, vol.45 supl.1 [consultado el 4 de junio de 2010], p.35-39. ISSN 0001-6004.
- ↑ Brunicardi, F. (1994). «Chest wall, pleura, lung and mediastinum». Schartz: Principios de cirugía (8va edición). McGraw-Hill. p. 741. ISBN 9789701053737. Citado en Rev Cubana Cir 2000;39(3):204-7 Archivado el 5 de noviembre de 2011 en Wayback Machine.
- ↑ VILA COSTAS, J. J. Ultrasonografía endoscópica sectorial: situación actual e indicaciones. Rev. esp. enferm. dig. [online]. 2005, vol.97, n.12 [consultado el 10 de agosto de 2010], pp. 899-906. ISSN 1130-0108. doi: 10.4321/S1130-01082005001200006.
- ↑ CancerPulmon.es (noviembre de 2007). «Diagnóstico del cáncer de pulmón». Archivado desde el original el 24 de octubre de 2010. Consultado el 30 de diciembre de 2010.
- ↑ por MedlinePlus (mayo de 2010). «Mediastinoscopia con biopsia». Enciclopedia médica en español. Consultado el 18 de septiembre de 2010.
- ↑ FUENTES VALDES, Edelberto. Mediastinotomía anterior y mediastinoscopia cervical en el diagnóstico de las lesiones tumorales mediastinales. Rev Cubana Cir [online]. 2005, vol.44, n.1; consultado el 18 de septiembre de 2010. ISSN 0034-7493.
- ↑ Fernando Abdala, Oscar Abdala, Claudia Poleri, Karina Patané, Oscar Rojas y Moisés Rosenberg (2006). Utilidad de la mediastinoscopía sistemática en el diagnóstico y la estadificación del cáncer de pulmón. Revista Argentina de Medicina Respiratoria, n. 1: pág 51-53; consultado el 18 de septiembre de 2010
- ↑ International Association for the Study of Lung Cancer
- ↑ Martin-Ucar AE, Nakas A, Pilling JE, West KJ, Waller DA. A case-matched study of anatomical segmentectomy versus lobectomy for stage I lung cancer in high-risk patients (en inglés). Eur J Cardiothorac Surg. 2005;27(4):675-9.
- ↑ a b c d e Instituto Nacional del Cáncer (febrero de 2008). «Cáncer de pulmón de células no pequeñas: Tratamiento (PDQ®)». Archivado desde el original el 30 de enero de 2010. Consultado el 16 de enero de 2010.
- ↑ El-Sherif, A; Gooding WE, Santos R et al. (agosto de 2006). «Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: a 13-year analysis». Annals of Thoracic Surgery 82 (2): 408-415. PMID 16863738.
- ↑ Strand, TE; Rostad H, Damhuis RA, Norstein J (junio de 2007). «Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude». Thorax (BMJ Publishing Group Ltd.). PMID 17573442.
- ↑ A. Wein y col. Impacto de la cirugía sobre la supervivencia en pacientes paliativos con cáncercolorrectal metastásico después del tratamiento de primera línea con infusión semanal de 24 horas de 5-fluorouracilo y ácido folínico a dosis altas (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). (en español). Annals of Oncology 11: 223-230; 2002. Último acceso 13 de mayo de 2008.
- ↑ a b c Grupo de Medicina Basada en la Evidencia - Hospital Universitario 12 de Octubre. Carcinoma broncogénico: FASE B – Clínica Respiratoria Archivado el 10 de febrero de 2009 en Wayback Machine. (en español). Último acceso 13 de mayo de 2008.
- ↑ HERRERA V., José M., ROSSI F., Ricardo, HARRIS D., Paul et al. Progresos en el tratamiento y seguimiento de hepatoblastoma: Análisis de una serie de 9 niños. Rev. chil. pediatr. [online]. ene. 2002, vol.73, no.1 [consultado el 13 de mayo de 2008], p.43-50. Disponible en la World Wide Web: [5]. ISSN 0370-4106.
- ↑ SAINZ MENENDEZ, Benito. Tumores benignos y malignos del pulmón: Clasificación. Diagnóstico. Tratamiento. Rev Cubana Cir. [online]. jul.-dic. 2006, vol.45, no.3-4 [consultado el 13 de mayo de 2008], p.0-0. Disponible en la World Wide Web: [6]. ISSN 0034-7493.
- ↑ Instituto Nacional del Cáncer (Estados Unidos) (2008). «Radioterapia para cáncer: preguntas y respuestas». Consultado el 19 de septiembre de 2010.
- ↑ Fernando, HC; Santos RS, Benfield JR et al. (febrero de 2005). «Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer». Journal of Thoracic and Cardiovascular Surgery 129 (2): 261-267. PMID 15678034.
- ↑ Manual Merck de Información Médica para el Hogar (2005-2008). «Capítulo 45: Cáncer de pulmón». Sección 4: Trastornos del aparato respiratorio. Archivado desde el original el 18 de junio de 2010. Consultado el 10 de agosto de 2010.
- ↑ Cancer Research UK (11 de septiembre de 2009). «Lung cancer radiotherapy side effects» (en inglés). Consultado el 10 de agosto de 2010.
- ↑ Hall, Eric J. (2000). Radiobiology for the radiologist. Philadelphia: Lippincott Williams Wilkins. p. 351. ISBN 9780781726498.
- ↑ por MedlinePlus (febrero de 2009). «Quimioterapia para el cáncer». Enciclopedia médica en español. Consultado el 22 de agosto de 2009.
- ↑ a b c por MedlinePlus (septiembre de 2008). «Quimioterapia». Enciclopedia médica en español. Consultado el 22 de agosto de 2009.
- ↑ Murray, N; Turrisi AT (marzo de 2006). «A review of first-line treatment for small-cell lung cancer». Journal of Thoracic Oncology 1 (3): 270-278. PMID 17409868.
- ↑ Clegg, A; Scott DA, Hewitson P et al. (enero de 2002). «Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review». Thorax (BMJ Publishing Group Ltd) 57 (1): 20-28. PMID 11809985.
- ↑ a b MORERA, R. et al. Progresos de radioquimioterapia en cáncer de pulmón no microcítico (en español). Oncología (Barc.) [online]. 2004, vol.27, n.6 [consultado el 24 de diciembre de 2009], pp. 80-83. ISSN 0378-4835.
- ↑ Schellens, Jan H. M.; Howard L. McLeod y David R. Newell (2005). Cancer clinical pharmacology. Oxford University Press. pp. 151-152. ISBN 0192629662.
- ↑ National Institute for Health and Clinical Excellence. «Pemetrexed for the first-line treatment of non-small-cell lung cancer» (en inglés). Consultado el 9 de diciembre de 2010.
- ↑ Azim, HA; Ganti AK (marzo de 2007). «Treatment options for relapsed small-cell lung cancer». Anticancer drugs 18 (3): 255-261. PMID 17264756.
- ↑ MacCallum, C; Gillenwater HH (julio de 2006). «Second-line treatment of small-cell lung cancer». Current Oncology Reports 8 (4): 258-264. PMID 17254525.
- ↑ Albers, J; Chaudhry V, Cavaletti G, Donehower R (octubre de 2006). «Intervenciones para la prevención de la neuropatía por cisplatino y compuestos relacionados». La Biblioteca Cochrane Plus (3). ISSN 1745-9990.
- ↑ Tramer MR, Carroll D, Campbell FA, Reynolds DJ, Moore RA, McQuay HJ. Cannabinoids for control of chemotherapy induced nausea and vomiting: quantitative systematic review. BMJ 2001;323:16-21. PMID 11440936.
- ↑ Instituto Nacional del Cáncer estadounidense. «Terapias biológicas del cáncer: preguntas y respuestas». Archivado desde el original el 23 de noviembre de 2010. Consultado el 27 de noviembre de 2010.
- ↑ http://www.cancer.gov/cancertopics/pdq/treatment/non-small-cell-lung/healthprofessional/page11=. Falta el
|título=(ayuda) (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). - ↑ https://es.wikipedia.org/wiki/Racotumomab
|url=incorrecta con autorreferencia (ayuda). Falta el|título=(ayuda) - ↑ Provencio M, Sánchez A, Garrido P, Valcárcel F. New molecular targeted therapies integrated with radiation therapy in lung cancer (en inglés). Clin Lung Cancer. 2010 Mar 1;11(2):91-7. PMID 20199974
- ↑ Rossi A, Maione P, Bareschino MA, Schettino C, Sacco PC, Ferrara ML, Castaldo V, Gridelli C. The emerging role of histology in the choice of first-line treatment of advanced non-small cell lung cancer: implication in the clinical decision-making (en inglés). Curr Med Chem. 2010;17(11):1030-8. PMID 20156162
- ↑ a b ERAZO B, Marcia; AMIGO C, Hugo; OYARZUN G, Manuel y PERUGA U, Armando. Tabaquismo activo y cáncer pulmonar: Determinación de fracciones atribuibles por sexo (en español). Rev. méd. Chile [online]. 2008, vol.136, n.10 [consultado el 6 de febrero de 2010], pp. 1272-1280. ISSN 0034-9887. doi: 10.4067/S0034-98872008001000006.
- ↑ Parent, ME; Rousseau MC, Boffetta P et al. (enero de 2007). «Exposure to diesel and gasoline engine emissions and the risk of lung cancer». American Journal of Epidemiology 165 (1): 53-62. PMID 17062632.
- ↑ Piédrola Gil, Gonzalo (2000). Medicina preventiva y salud pública (10ma edición). Elsevier España. p. 711. ISBN 8445810243.
- ↑ Eddy DM (1986). Secondary prevention of cancer: an overview (artículo completo disponible en inglés). Bulletin of the World Health Organization, 64 (3): 421-429 (1986). Consultado 22 de septiembre de 2010.
Enlaces externos[editar]
- Actualización sobre Cáncer de Pulmón para médicos Medscape en español
- Cáncer de pulmón Archivado el 5 de enero de 2012 en Wayback Machine. (Noticias e información acerca del cáncer de pulmón)
- Situación epidemiológica y pronóstica del cáncer de pulmón en España. En Archh Bronconeumol 2006;42(11):594-9
- Carcinoma broncogéncio. Revisión del Grupo MBE del Hospital 12 de octubre(marzo de 2007)
- El cáncer de pulmón, ficha informativa del National Cancer Institute
- Tutoriales Interactivos de Salud Medline Plus: Cáncer de pulmón Utiliza gráficas animadas y se puede escuchar el tutorial
- Gen en cáncer de pulmón de no fumadores Archivado el 11 de abril de 2021 en Wayback Machine.
- Vaxira Racotumomab vacuna contra el cáncer de pulmón avanzado Archivado el 3 de agosto de 2014 en Wayback Machine.
- Lung cancer - survival statistics. Cancer Research UK (en inglés).
- El contenido de este artículo incorpora material de una entrada de la Enciclopedia Libre Universal, publicada en español bajo la licencia Creative Commons Compartir-Igual 3.0.
