Diferencia entre revisiones de «Molécula de agua»
Revertidos los cambios de 190.42.235.107 a la última edición de |
|||
| Línea 74: | Línea 74: | ||
=== Adhesión === |
=== Adhesión === |
||
El agua, por su gran potencial de polaridad, cuenta con la propiedad de la [[adhesión]], es decir, el agua generalmente es atraída y se mantiene adherida a otras superficies. a cualquiera de las superficies sin excluir ninguna |
El agua, por su gran potencial de polaridad, cuenta con la propiedad de la [[adhesión]], es decir, el agua generalmente es atraída y se mantiene adherida a otras superficies. a cualquiera de las superficies sin excluir ninguna |
||
tambien se da en las plastas la adhesión. |
|||
=== Tensión superficial === |
=== Tensión superficial === |
||
Revisión del 21:23 8 jun 2010
| Molécula de agua | ||
|---|---|---|
  | ||
| Nombre IUPAC | ||
|
Oxidano[1] Agua | ||
| General | ||
| Otros nombres |
Óxido de hidrógeno Hidróxido de hidrógeno Hidrato Ácido hídrico Monóxido de dihidrógeno Óxido de dihidrógeno R-718 Dihidruro de oxígeno Ácido hidroxílico Hidróxido de hidronio Ácido hidróxico Agua leve Agua común | |
| Fórmula semidesarrollada | HOH | |
| Fórmula molecular | H2O | |
| Identificadores | ||
| Número CAS | 7732-18-5[2] | |
| Número RTECS | ZC0110000 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 1000 kg/m³; 1 g/cm³ | |
| Masa molar | 1 801 528 g/mol | |
| Punto de fusión | 273,15 K (0 °C) | |
| Punto de ebullición | 373,15 K (100 °C) | |
| Presión crítica | 217.7 atm | |
| Estructura cristalina | Hexagonal (véase hielo) | |
| Propiedades químicas | ||
| Acidez | 15,74 pKa | |
| Solubilidad en agua | 100% | |
| Momento dipolar | 1,85 D | |
| Termoquímica | ||
| ΔfH0gas | -241,83 kJ/mol | |
| ΔfH0líquido | -285,83 kJ/mol | |
| S0gas, 1 bar | 188,84 J·mol–1·K | |
| S0líquido, 1 bar | 41 J·mol–1·K–1 | |
| Capacidad calorífica (C) | 1 | |
| Riesgos | ||
| Ingestión | Necesaria para la vida; su consumo excesivo puede producir dolores de cabeza, confusión y calambres. Puede ser fatal en atletas. | |
| Inhalación | No es tóxica. Puede disolver el surfactante de los pulmones. La sofocación en el agua se denomina ahogo. | |
| Piel | La inmersión prolongada puede causar descamación. | |
| Ojos | No es peligrosa para los ojos, a no ser que tenga cloro, con el cual los ojos se irritan. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El agua es un compuesto químico formado por dos átomos de hidrógeno (H) y uno de oxígeno (O). Proveniente del latín aqua.
Propiedades físicas y químicas
El agua pura no tiene olor, sabor, ni color, es decir, es incolora, insípida e inodora. Su importancia reside en que casi la totalidad de los procesos químicos que suceden en la naturaleza, no solo en organismos vivos sino también en la superficie no organizada de la tierra, así como los que se llevan a cabo en laboratorios y en la industria, tienen lugar entre sustancias disueltas en agua.
Henry Cavendish descubrió en 1781 que el agua es una sustancia compuesta y no un elemento, como se pensaba desde la Antigüedad. Los resultados de dicho descubrimiento fueron desarrollados por Antoine Laurent de Lavoisier dando a conocer que el agua estaba formada por oxígeno e hidrógeno. En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt publicaron un documento científico que demostraba que el agua estaba formada por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
Entre las moléculas de agua se establecen enlaces por puentes de hidrógeno debido a la formación de dipolos electrostáticos que se originan al situarse un átomo de hidrógeno entre dos átomos más electronegativos, en este caso de oxígeno. El oxígeno, al ser más electronegativo que el hidrógeno, atrae más, hacia este, los electrones compartidos en los enlaces covalentes con el hidrógeno, cargándose negativamente, mientras los átomos de hidrógeno se cargan positivamente, estableciéndose así dipolos eléctricos. Los enlaces por puentes de hidrógeno son enlaces por fuerzas de van der Waals de gran magnitud, aunque son unas 20 veces más débiles que los enlaces covalentes.
Los enlaces por puentes de hidrógeno entre las moléculas del agua pura son responsables de la dilatación del agua al solidificarse, es decir, su disminución de densidad cuando se congela. En estado sólido, las moléculas de agua se ordenan formando tetraedros, situándose en el centro de cada tetraedro un átomo de oxígeno y en los vértices dos átomos de hidrógeno de la misma molécula y otros dos átomos de hidrógeno de otras moléculas que se enlazan electrostáticamente por puentes de hidrógeno con el átomo de oxígeno. La estructura cristalina resultante es muy abierta y poco compacta, menos densa que en estado líquido. El agua tiene una densidad máxima de 1 g/cm³ cuando está a una temperatura de 4 ºC, característica especialmente importante en la naturaleza que hace posible el mantenimiento de la vida en medios acuáticos sometidos a condiciones exteriores de bajas temperaturas.
La dilatación del agua al solidificarse también tiene efectos importantes en los procesos geológicos de erosión. Al introducirse agua en grietas del suelo y congelarse posteriormente, se originan tensiones que rompen las rocas.
Disolvente
El agua es descrita muchas veces como el solvente universal, porque disuelve muchos de los compuestos conocidos. Sin embargo, no lo es (aunque es tal vez lo más cercano), porque no disuelve a todos los compuestos y, de hacerlo, no sería posible construir ningún recipiente para contenerla.
El agua es un disolvente polar, más polar, por ejemplo, que el etanol. Como tal, disuelve bien sustancias iónicas y polares, como la sal de mesa (cloruro de sodio). No disuelve, de manera apreciable, sustancias fuertemente apolares, como el azufre en la mayoría de sus formas alotrópicas, además, es inmiscible con disolventes apolares, como el hexano. Esta cualidad es de gran importancia para la vida.
Esta selectividad en la disolución de distintas clases de sustancias se debe a su capacidad para formar puentes de hidrógeno con otras sustancias que pueden presentar grupos polares, o con carga iónica, como: alcoholes, azúcares con grupos R-OH, aminoácidos y proteínas con grupos que presentan cargas parciales + y − dentro de la molécula, lo que da lugar a disoluciones moleculares. También, las moléculas de agua pueden disolver sustancias salinas que se disocian formando disoluciones iónicas.
En las disoluciones iónicas, los iones de las sales orientan, debido al campo eléctrico que crean a su alrededor, a los dipolos del agua, quedando "atrapados" y recubiertos de moléculas de agua en forma de iones hidratados o solvatados.
Algunas sustancias, sin embargo, no se mezclan bien con el agua, incluyendo aceites y otras sustancias hidrofóbicas. Membranas celulares, compuestas de lípidos y proteínas, aprovechan esta propiedad para controlar las interacciones entre sus contenidos químicos y los externos, lo que se facilita, en parte, por la tensión superficial del agua.
La capacidad disolvente es responsable de:
- Las funciones metabólicas
- Los sistemas de transporte de sustancias en los organismos
Polaridad
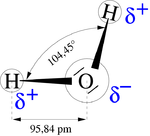
La molécula de agua es muy polar, puesto que hay una gran diferencia de electronegatividad entre el hidrógeno y el oxígeno. Los átomos de oxígeno son mucho más electronegativos (atraen más a los electrones) que los de hidrógeno, lo que dota a los dos enlaces de una fuerte polaridad eléctrica, con un exceso de carga negativa del lado del oxígeno, y de carga positiva del lado de los hidrógenos. Los dos enlaces no están opuestos, sino que forman un ángulo de 104,45° debido a la hibridación sp3 del átomo de oxígeno así que, en conjunto, los tres átomos forman un molécula angular, cargado negativamente en el vértice del ángulo, donde se ubica el oxígeno y, positivamente, en los extremos de la molécula, donde se encuentran los hidrógenos. Este hecho tiene una importante consecuencia, y es que las moléculas de agua se atraen fuertemente, adhiriéndose por donde son opuestas las cargas. En la práctica, un átomo de hidrógeno sirve como puente entre el átomo de oxígeno al que está unido covalentemente y el oxígeno de otra molécula. La estructura anterior se denomina enlace de hidrógeno o puente de hidrógeno.
El hecho de que las moléculas de agua se adhieran electrostáticamente, a su vez modifica muchas propiedades importantes de la sustancia que llamamos agua, como la viscosidad dinámica, que es muy grande, o los puntos (temperaturas) de fusión y ebullición o los calores de fusión y vaporización, que se asemejan a los de sustancias de mayor masa molecular.
Cohesión
La cohesión es la propiedad con la que las moléculas de agua se atraen entre sí. Debido a esta interacción se forman cuerpos de agua por adhesión de moléculas de agua, las gotas.
Los puentes de hidrógeno mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible. Al no poder comprimirse puede funcionar en algunos animales como un esqueleto hidrostático, como ocurre en algunos gusanos perforadores capaces de agujerear la roca mediante la presión generada por sus líquidos internos. Estos puentes se pueden romper fácilmente con la llegada de otra molécula con un polo negativo o positivo dependiendo de la molécula, o, con el calor.
La fuerza de cohesión permite que el agua se mantenga líquida a temperaturas no extremas.
Adhesión
El agua, por su gran potencial de polaridad, cuenta con la propiedad de la adhesión, es decir, el agua generalmente es atraída y se mantiene adherida a otras superficies. a cualquiera de las superficies sin excluir ninguna
Tensión superficial

Por su misma propiedad de cohesión, el agua tiene una gran atracción entre las moléculas de su superficie, creando tensión superficial. La superficie del líquido se comporta como una película capaz de alargarse y al mismo tiempo ofrecer cierta resistencia al intentar romperla; esta propiedad contribuye a que algunos objetos muy ligeros floten en la superficie del agua.
Debido a su elevada tensión superficial, algunos insectos pueden estar sobre ella sin sumergirse e, incluso, hay animales que corren sobre ella, como el basilisco. También es la causa de que se vea muy afectada por fenómenos de capilaridad.
Las gotas de agua son estables también debido a su alta tensión superficial. Esto se puede ver cuando pequeñas cantidades de agua se ponen en superficies no solubles, como el vidrio, donde el agua se agrupa en forma de gotas.
Acción capilar
El agua cuenta con la propiedad de la capilaridad, que es la propiedad de ascenso, o descenso, de un líquido dentro de un tubo capilar. Esto se debe a sus propiedades de adhesión y cohesión.
Cuando se introduce un capilar en un recipiente con agua, ésta asciende espontáneamente por el capilar como si trepase "agarrándose" por las paredes, hasta alcanzar un nivel superior al del recipiente, donde la presión que ejerce la columna de agua se equilibra con la presión capilar. A este fenómeno se debe, en parte, la ascensión de la savia bruta, desde las raíces hasta las hojas, a través de los vasos leñosos.
Calor específico
Esta propiedad también se encuentra en relación directa con la capacidad del agua para formar puentes de hidrógeno intermoleculares. El agua puede absorber grandes cantidades de calor que es utilizado para romper los puentes de hidrógeno, por lo que la temperatura se eleva muy lentamente. El calor específico del agua se define como la cantidad de energía necesaria para elevar la temperatura, en un grado celsius, a un gramo de agua en condiciones estándar y es de 1 cal/°C•g, que es igual a 4,1840 J/C•g.
Esta propiedad es fundamental para los seres vivos (y la Biosfera en general) ya que gracias a esto, el agua reduce los cambios bruscos de temperatura, siendo un regulador térmico muy bueno. Un ejemplo de esto son las temperaturas tan suaves que hay en las zonas costeras, que son consecuencias de estas propiedad. También ayuda a regular la temperatura de los animales y las células permitiendo que el citoplasma acuoso sirva de protección ante los cambios de temperatura. Así se mantiene la temperatura constante.
La capacidad calorífica del agua es mayor que la de otros líquidos.
Para evaporar el agua se necesita mucha energía. Primero hay que romper los puentes y posteriormente dotar a las moléculas de agua de la suficiente energía cinética para pasar de la fase líquida a la gaseosa. Para evaporar un gramo de agua se precisan 540 calorías, a una temperatura de 20 °C.
Temperatura de fusión y evaporación
Presenta un punto de ebullición de 100 °C (373,15 K) a presión de 1 atmósfera (se considera como estándar para la presión de una atmósfera la presión promedio existente al nivel del mar). El calor latente de evaporación del agua a 100 °C es 540 cal/g (ó 2260 J/g).
Tiene un punto de fusión de 0 °C (273,15 K) a presión de 1 atm. El calor latente de fusión del hielo a 0 °C es 80 cal/g (ó 335 J/g). Tiene un estado de sobreenfriado líquido a −25 °C.
La temperatura crítica del agua, es decir, aquella a partir de la cual no puede estar en estado líquido independientemente de la presión a la que esté sometida, es de 374 ºC y se corresponde con una presión de 217,5 atmósferas.
Densidad
La densidad del agua líquida es muy estable y varía poco con los cambios de temperatura y presión.
A la presión normal (1 atmósfera), el agua líquida tiene una mínima densidad a los 100 °C, donde tiene 0,958 kg/L. Mientras baja la temperatura, aumenta la densidad (por ejemplo, a 90 °C tiene 0,965 kg/L) y ese aumento es constante hasta llegar a los 3,8 °C donde alcanza una densidad de 1 kg/L. A esa temperatura (3,8 °C) alcanza su máxima densidad (a la presión mencionada). A partir de ese punto, al bajar la temperatura, la densidad comienza a disminuir, aunque muy lentamente, hasta que a los 0 °C disminuye hasta 0,9999 kg/L. Cuando pasa al estado sólido (a 0 °C), ocurre una brusca disminución de la densidad pasando de 0,9999 kg/L a 0,917 kg/L.
Cristalización
La cristalización es el proceso por el que el agua pasa de su estado líquido al sólido cuando la temperatura disminuye de forma continua.
Otras propiedades
- No posee propiedades ácidas ni básicas.
- Con ciertas sales forma hidratos.
- Reacciona con los óxidos de metales formando bases.
- Es catalizador en muchas reacciones químicas.
- Presenta un equilibrio de autoionización, en el cual hay iones H3O+ y OH−.
Estudio Hidrobiológico
La realización de un estudio hidrobiológico permite:
Proporcionar datos sobre el estado de un sistema acuático de forma regular. Documentar la variabilidad a corto y largo plazo de la calidad del agua por fenómenos naturales o actividades humanas. Evaluar el impacto de la polución producido por la actividad humana. Evaluar la influencia de ciertas zonas de muestreo sobre la fauna del lugar. Evaluar las características hidráulicas del cauce del río y la evolución del caudal mediante medidas de flujo. De esta manera, se puede establecer las variaciones de caudal que sufre el río a lo largo de ciclo estacional y anual. Realizar un estudio de la rivera. Evaluar los Índices Biológicos.
Destilación
Para obtener agua químicamente pura es necesario realizar diversos procesos físicos de purificación ya que el agua es capaz de disolver una gran cantidad de sustancias químicas, incluyendo gases.
Se llama agua destilada al agua que ha sido evaporada y posteriormente condensada. Al realizar este proceso se eliminan casi la totalidad de sustancias disueltas y microorganismos que suele contener el agua y el resultado es prácticamente la sustancia química pura H2O.
El agua pura no conduce la electricidad, pues está libre de sales y minerales.
Importancia de la posición astronómica de la Tierra
La coexistencia de las fases sólidas, líquidas y gaseosas pero, sobre todo, la presencia permanente de agua líquida, es vital para comprender el origen y la evolución de la vida en la Tierra tal como es. Sin embargo, si la posición de la Tierra en el Sistema Solar fuera más cercana o más alejada del Sol, la existencia de las condiciones que permiten a las formas del agua estar presentes simultáneamente serían menos probables.
La masa de la Tierra permite mantener la atmósfera. El vapor de agua y el dióxido de carbono en la atmósfera causan el efecto invernadero, lo que ayuda a mantener relativamente constante la temperatura superficial. Si el planeta tuviera menos masa, una atmósfera más delgada causaría temperaturas extremas no permitiendo la acumulación de agua excepto en los casquetes polares (como en Marte). De acuerdo con el modelo nébula solar de la formación del Sistema Solar, la masa de la Tierra se debe en gran parte a su distancia al Sol.
La distancia entre el Sol y la Tierra y la combinación de radiación solar recibida y el efecto invernadero en la atmósfera aseguran que su superficie no sea demasiado fría o caliente para el agua líquida. Si la Tierra estuviera más alejada del Sol, el agua líquida se congelaría. Si estuviera más cercana, su temperatura superficial elevada limitaría la formación de las capas polares o forzaría al agua a existir solo como vapor. En el primer caso, la baja reflectibilidad de los océanos causaría la absorción de más energía solar. En el último caso, la Tierra sería inhabitable (al menos por las formas de vida conocidas) y tendría condiciones semejantes a las del planeta Venus.
Las teorías Gaia proponen que la vida se mantiene adecuada a las condiciones por sí misma al afectar el ambiente de la Tierra.
El cambio del estado en el agua

Estado sólido
Al estar el agua en estado sólido, todas las moléculas se encuentran unidas mediante un enlace de hidrógeno, que es un enlace intermolecular y forma una estructura parecida a un panal de abejas, lo que explica que el agua sea menos densa en estado sólido que en el estado líquido. La energía cinética de las moléculas es muy baja, es decir que las moléculas están casi inmóviles.
El agua glacial sometida a extremas temperaturas y presiones criogénicas, adquiere una alta capacidad de sublimación, al pasar de sólida a vapor por la acción energética de los elementos que la integran —oxígeno e hidrógeno— y del calor atrapado durante su proceso de congelación-expansión. Es decir, por su situación de confinamiento a grandes profundidades se deshiela parcialmente, lo cual genera vapor a una temperatura ligeramente superior del helado entorno, suficiente para socavar y formar cavernas en el interior de los densos glaciales. Estas grutas, que además contienen agua proveniente de sistemas subglaciales, involucran a las tres fases actuales del agua, donde al interactuar en un congelado ambiente subterráneo y sin la acción del viento se transforman en el cuarto estado del agua: plasma semilíquido o gelatinoso.

Estado líquido
Cuando el agua está en estado líquido, al tener más temperatura, aumenta la energía cinética de las moléculas, por lo tanto el movimiento de las moléculas es mayor, produciendo quiebres en los enlaces de hidrógeno, quedando algunas moléculas sueltas, y la mayoría unidas.
Estado gaseoso
Cuando el agua es gaseosa, la energía cinética es tal que se rompen todos los enlaces de hidrógeno quedando todas las moléculas libres. El vapor de agua es tan invisible como el aire; el vapor que se observa sobre el agua en ebullición o en el aliento emitido en aire muy frío, está formado por gotas microscópicas de agua líquida en suspensión; lo mismo que las nubes.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Molécula de agua.
Wikimedia Commons alberga una categoría multimedia sobre Molécula de agua. Wikiquote alberga frases célebres de o sobre Molécula de agua.
Wikiquote alberga frases célebres de o sobre Molécula de agua.
Referencias
- ↑ Nomenclatura de Química Inorgánica. Recomendaciones de la IUPAC de 2005. Ciriano López, Miguel Ángel; Román Polo, Pascual (versión española), Connelly, Neil G. (ed.), Damhus, Ture (ed.) Prensas Universitarias de Zaragoza, 2007
- ↑ Número CAS
